学校の先生や塾の先生、
ウェブ上で化学を教えている人はみんな、
「無機化学は暗記科目」
と教えています。
確かに暗記しないといけないことはたくさんあるし、
大変な分野であるのは間違いありません。
しかし、
あなたを含めた世の中の受験生は、
必要以上の「丸暗記」を強いられています。
「理由はわからんけどこんな性質らしい」
「理由はわからんけどこんな反応が起こるらしい」
あなたもこんな感情を抱きながら、
無機化学を勉強しているのではないでしょうか。
そんな無機化学の暗記を楽にするために、
ここでは無機化学で覚えるべき反応を「すべて」まとめました。
反応の仕組みを理解することで、
無限に思える反応も「たった6つ」に集約できるのです。
今まで反応式を1つ1つ覚えていた人、
理由もわからず化学反応を考えていた人は、
ぜひ最後まで読んでみてください。
目次
無機化学を支配する6つの反応
化学反応は無限に存在するため、
反応をすべて羅列することは不可能です。
しかし、
化学反応が起こる仕組みに注目すれば、
無機化学の反応は6つに分類できます。
そして反応の仕組みさえ分かっていれば、
反応式をその場で作ることができるのです。
教科書で出会う反応をすべて「理解」でき、
さらには試験場で初めて見たような反応でも
迷わずに解けるようになります。
それでは6つの反応を順番に見ていきましょう。
① 酸化還元反応
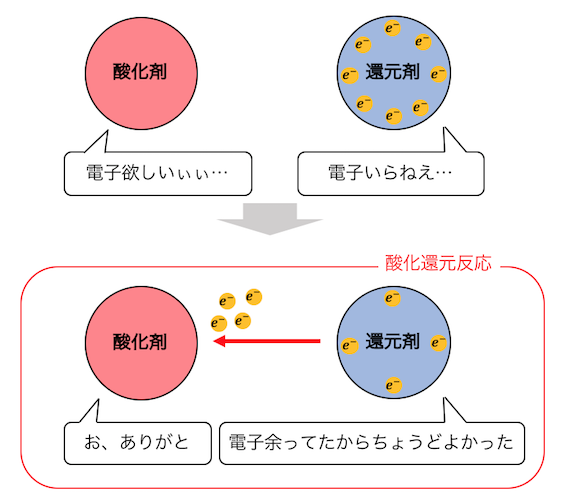
まず1つ目の反応は「酸化還元反応」です。
酸化還元反応は、
電子を欲しがるやつと電子を渡したがるやつが、
Win-Winの関係になる反応です。
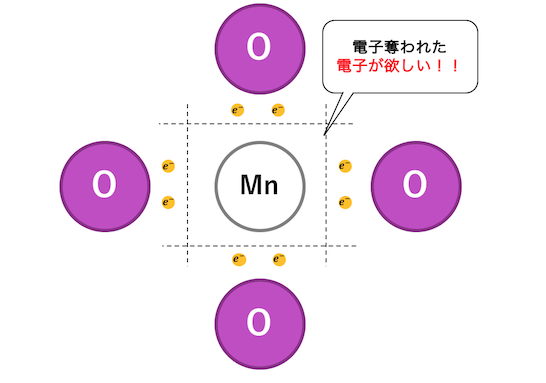
電子を欲しがるやつの例にはMnO4–があります。
普通Mn2+の状態のマンガンが酸素Oに電子を奪われ、
いかにも電子を奪いそうです。
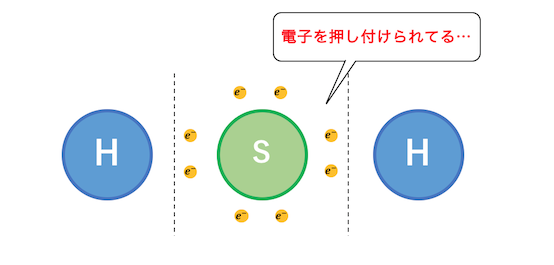
電子を渡したがるやつの例にはH2Sがあります。
水素に電子を押し付けられて、
最外殻がいっぱいになってしまっています。
いかにも電子を押し付けそうです。
そんなやつらが出会って起こる反応が、
酸化還元反応です。
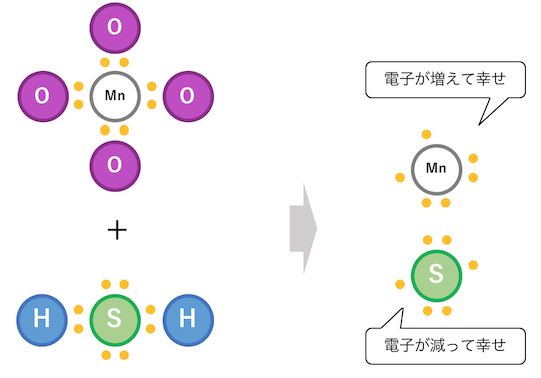
このように、
酸化数の差によって引き起こされる反応が
酸化還元反応だということです。
酸化還元反応は一度説明していますので
より細かい説明は以下のリンクを踏んでください。
「半反応式ってどうやって作るの?」
なんて人は上のリンクをクリック!
② 中和反応・沈殿反応
2つ目の反応は中和反応と沈殿反応。
なぜこれらをまとめているかというと、
どちらの反応も発生の仕組みが同じだからです。
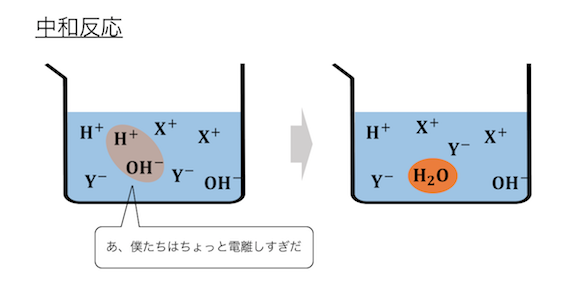
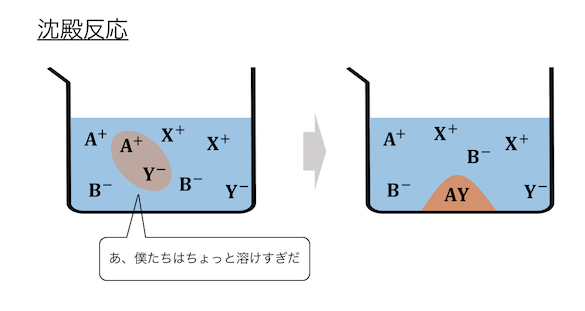
電離できる量に限界を超えることで、
分子になってしまう反応ですね。
より詳しくは以下の記事を参考にしてみてください。
③ 錯イオン形成反応
沈殿生成に続いて大切な反応が錯イオン形成反応。
またの名を「配位子交換反応」。
例えば、溶液中の亜鉛イオンは、
[Zn(H2O)4]2+の形で存在しています。
ここにOH–がぶつかってくることで、
配位子が次々と交換されていきます。
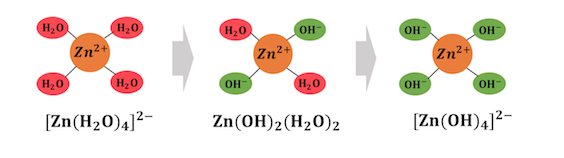
>このように、
水の錯イオンとして存在する金属にぶつかって、
水の代わりに配位子となっていく反応が、
錯イオン形成反応です。
もっと詳しい説明は以下参照。
④ 弱酸弱塩基遊離反応
化学平衡の仕組みから発生するのが、
4つ目の反応の弱酸弱塩基遊離反応です。
化学平衡とは、
「エネルギーを放出する力」
「バラバラになろうとする力」
のせめぎ合いによって起こる現象です。
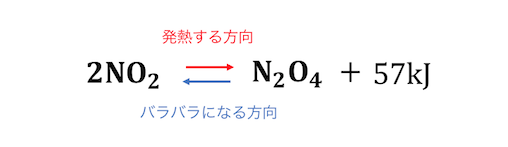
弱酸弱塩基遊離反応は、
強酸(強塩基)と弱酸(弱塩基)の平衡のずれによって、
発生する反応ですね。
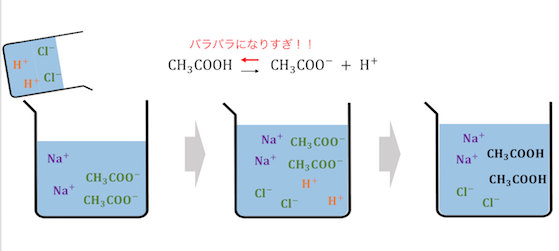
意外と影が薄い反応で無視されがちですが、
6つの反応の中でも1番仕組みが重要な反応です。
不安な人は下の記事で確認しておきましょう。
⑤ 揮発性の酸遊離反応
5つ目の反応が揮発性の酸遊離反応。
この反応の基本原理は弱酸遊離反応と同じです。
強酸であっても酸としての強さには差があります。
例えば塩酸と硫酸では、硫酸の方が圧倒的に強い酸です。
酸の強さに差があることで、
弱酸遊離と同じ原理が働きます。
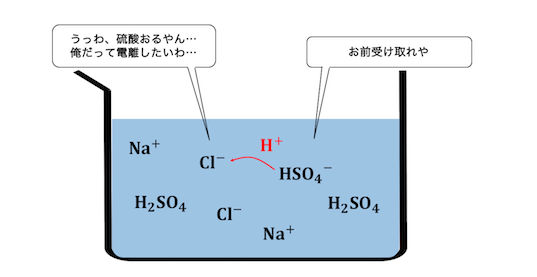
しかし塩酸だって強酸だから、
完全に遊離させられることはありません。
そこで溶液を温めてあげることで、
揮発性のある塩酸だけを追い出して、
無理やり反応を進めます。
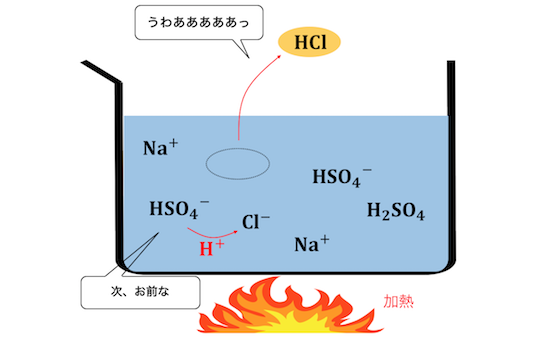
塩酸が減ることで平衡が傾き、
さらに塩酸が遊離されていきます。
このように、
弱酸遊離反応の原理に加熱を組み合わせて、
揮発性の強酸を遊離させるのが揮発性の酸遊離反応です。
より詳しい説明は以下をみてください。
⑥ 熱分解反応
最後の反応が熱分解反応です。
熱分解反応は、
外から熱を加えて無理やり反応を起こそうとする事で起こります。
反応の仕組みを「熱を加えたから」と簡単ですが、
無理やり発生させる分生成物の予測が難しいです。
よって、
熱分解反応に限っては式を1つ1つ暗記していくしかありません。
6つの反応のうちの、
唯一暗記の割合が大きい部分です。
入試レベルで覚えておくべき熱分解反応はまとめておいたので、
ぜひ参考にしてみてください。
気になる人はリンクをクリック!
まとめ
このように無機化学の反応は、
① 酸化還元反応
② 中和反応・沈殿反応
③ 錯イオン形成反応
④ 弱酸弱塩基遊離反応
⑤ 揮発性の酸遊離反応
⑥ 熱分解反応
の6つにまとめることができました。
無機化学で反応が出てくるたびに、
「これは6つのうちどの反応だろう」
「なぜこの反応が起こるのだろう」
と考えてあげると良いです。
反応の仕組みがわかるだけで、
圧倒的に暗記のスピードが上がります。
もしまだ理解が曖昧な部分があれば、
何度も読み返して完璧にしておきましょう。














⑤のリンク先が間違っているようですね
ほんとですね!
ご指摘ありがとうございますm(__)m