この記事では沈殿生成反応について解説します。
沈殿生成反応といえば、
ひたすら丸暗記・丸暗記・丸暗記!
で多くの人が苦労していますよね。
この暗記の大変さにとらわれて、
肝心の化学反応が起こる仕組みに、
目を向けられない人が多いです。
基本的に高校で習う無機化学の反応は6種類しかなく、
沈殿生成反応はその中の1つです。
沈殿生成反応を理解すれば、
高校で出会う化学式の6分の1を理解したことになります。
逆にきちんと反応の仕組みを理解しないと、
この先必要のない丸暗記が増え、
無機化学の暗記地獄にはまっていきます。
ここでは沈殿生成が起こる仕組みを説明していきますね。
化学反応を仕組みから理解することで、
二次試験で出題される「見たことのない問題」もスラスラ解けるようになります。
この記事の最後には、
沈殿の覚え方のコツもまとめておくので,
ぜひ読み飛ばさずに読んでみてください。
沈殿生成反応とは?
「沈殿生成反応」とは、
簡単にいえば2つの水溶液を混ぜたときに、水に溶けにくいイオンのペアが沈殿する反応です。
沈殿生成反応の仕組みはまさに、
化学平衡そのものです。
まずは簡単に化学平衡の復習をしましょう。
化学平衡の復習
「平衡状態」とは、
2つの逆向きの力が釣り合って動かない状態を指します。
化学平衡は化学反応が右向きに進む力と左向きに進む力が釣り合っているということですね。
これを言い換えると、
2つの別の力が反応を発生させている、
ということになります。
\[
\mathrm{ X^{+} + Y^{-} ⇄ XY }
\]
1つ目の力が、原子同士が引き合うミクロな力です。
クーロン力で引きあったり、
ある程度近づけば電気陰性度の高い原子が電子を引き寄せたりします。
この力によって右向きに反応が進みます。
\[
\mathrm{ X^{+} + Y^{-} ⇄ XY }
\]
2つ目の力が、集まった粒子がバラバラになろうとするマクロな力です。
例えば、
匂いの強いものを置くと部屋中に広がったり、
1滴のインクが水全体に広がったり、
と言うのをイメージすればいいでしょう。
この力によって左向きに反応が進みます。
\[
\mathrm{ X^{+} + Y^{-} ⇄ XY }
\]
以上の2つの力が釣り合うのが、
化学平衡状態です。
絶対にわかる!化学平衡の仕組み
沈殿生成反応の仕組み
下準備は整いました。
沈殿生成反応の仕組みを見ていきましょう。
沈殿生成反応は、水溶液を混ぜるところから始まります。
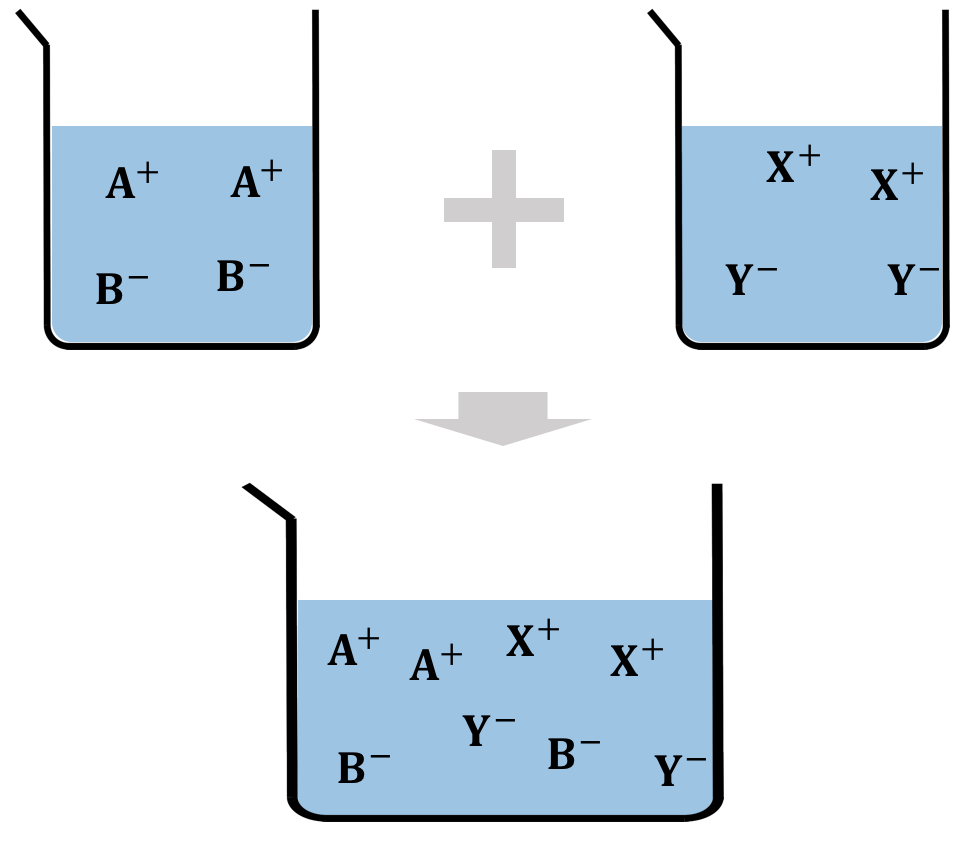
ここで一旦ストップ。
水溶液を混ぜた状態では、
あくまで個別にイオンが浮いているだけ、
と言うことに注意しましょう。
例えばNaOHとKOHを混ぜたなら、
単にNa+とK+とたくさんのOH–が浮いているだけで、
「NaOHから出たOH–」などと言う概念はありません。
水に溶かした時点でそれぞれ独立の粒子です。
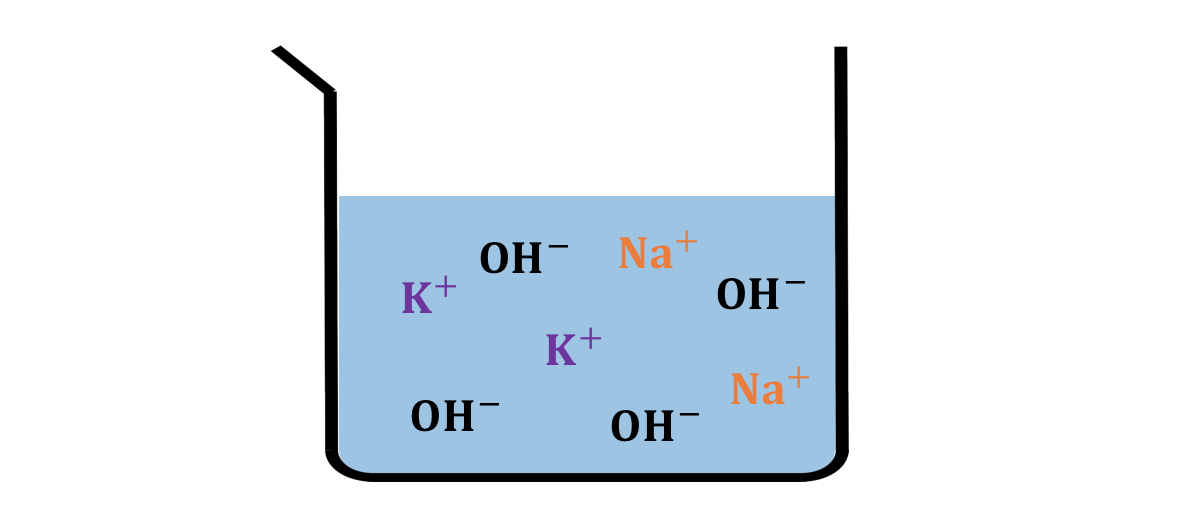
話を戻しましょう。
この溶液中ではイオンが4種類ありますから、
すべての組み合わせで化学平衡が起こっている必要があります。
A+とB–だったら気にならなかったけど、
Y–は引っ張る力が強いからAYになっちゃう、
なんてことが起こるわけです。
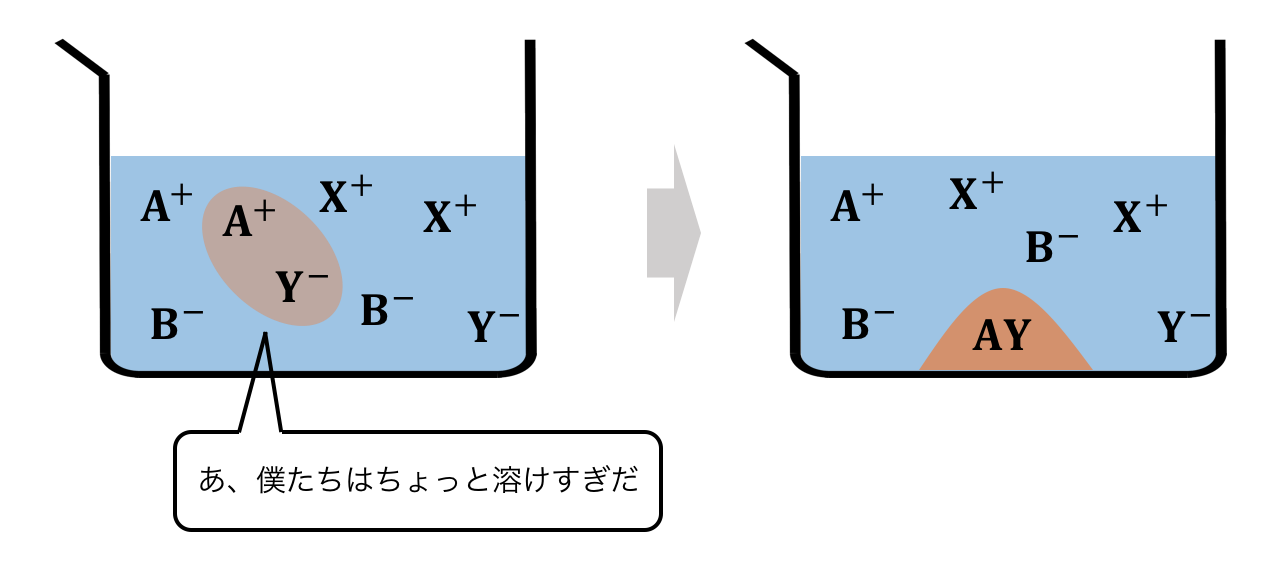
以上が沈殿生成反応の仕組みです。
水の中でどんなことが起こっているかイメージできましたか?
沈殿する物質の覚え方
水は極性が強いため、
一般的にはイオンが溶けやすいです。
つまり沈殿は例外にあたるため、
どうしても丸暗記になってしまうのです。
あくまで丸暗記しなくてはいけないことは、
前提にしておきましょう。
その上で覚えるコツ言うならば、
陰イオンごと・陽イオンごとに並べ、
その元素の性質として覚えていく、
ということになります。
例えば人を覚えるときも、
ただ単に名簿を暗記していくより、
得意なスポーツや好きな食べ物がわかったり、
場合によっては誰が仲がいいのかを知っていた方が覚えやすいのではないでしょうか。
沈殿の場合も、
「Ag+はCl–と仲がいいんだっけ」
「Cl–と仲がいいグループはPb2+とHg22+だったな」
と言うように覚えた方が定着します。
ちなみに覚える初期段階としては、
語呂合わせなども有効だと思います。
ただ語呂合わせだと思い出すのに時間がかかり、
さらにどの語呂合わせがどのイオンを指しているのかが、
ごちゃごちゃしてしまうので、
最終的には元素の性質として覚えるのをお勧めします。
具体的な沈殿に関しては、
別の記事でまとめているので、
ぜひそちらをごらんください。
まとめ
いかがでしたか?
今回は沈殿生成反応の仕組みの話でした。
溶液中では元の物質は関係なくなり、
溶液中の全てのイオン同士が平衡状態を保ちたいから、
特に平衡定数が小さいもの同士が沈殿を作ってしまうのでした。
無機化学の6つの反応の1つとして、
きちんとおさえておきましょう。














コメントを書く