同素体は覚えるべきことが多く、
なかなか知識が定着しませんよね。
「斜方硫黄だっけ?単斜硫黄だっけ?」
「そもそもどこまで覚えればいいの…」
などなど、
あなたも苦労しているのではないでしょうか?
ここでは入試レベルで必要な同素体の知識を、
網羅的にまとめました。
この記事を最後まで読むことで、
必要な同素体の知識が全て頭に入り、
最低限の復習で本番を迎えられます。
さらに参考として、
少し入試範囲を飛び出た同素体も解説しています。
ぜひ最後まで読んでみてください。
同素体とは
「同素体」とは、
同じ元素でできている単体だけど、
その並び方が違うもの同士のことです。
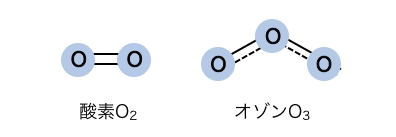
同素体の例は酸素O2とオゾンO3。
どちらも酸素原子Oからできている単体ですが、
その並び方が違います。
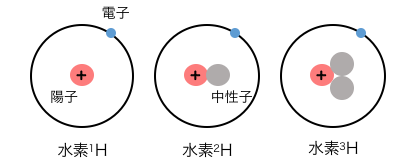
似た言葉に「同位体」がありますが、
これは原子の中身の中性子数による区別でしたね。
同素体は分子や結晶などの概念であるのに対し、
同位体は原子に対する概念です。
同素体に話を戻します。
同素体は構造の違いから化学的性質に違いが出てきます。
今回は入試レベルで覚えておくべき、
同素体の種類や性質についてまとめていきます。
同素体はSCOPで覚えよう

「同素体って種類が多そう…」
なんて思うかもしれませんが、全然そんなことはありません。
入試レベルで覚えるべき同素体は、
スコップ(硫黄S、炭素C、酸素O、リンP)
で覚えることができます。
とてもわかりやすいですね。
それでは順番に、
具体的な同素体を確認していきます。
①硫黄S

(http://goukakunokotu.seesaa.net/article/434909751.html)
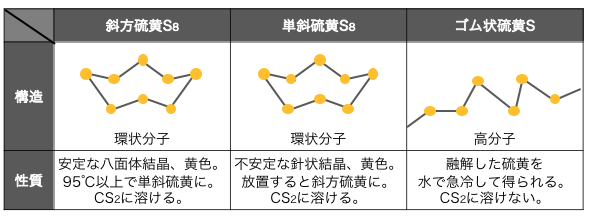
硫黄Sの同素体には、
⚫︎斜方硫黄S8 – 常温で最も安定
⚫︎単斜硫黄S8 – 徐々に斜方硫黄に変化
⚫︎ゴム状硫黄S – 高分子
があります。
まず斜方硫黄と単斜硫黄はどちらも、
以下のような分子の構造をしています。
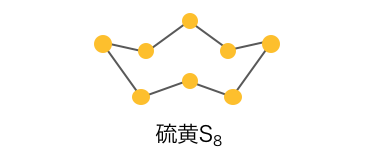
そして分子結晶の作り方の違いから、
この二つの同素体が出てくるのです。
斜方硫黄は正八面体の安定な結晶で、
それを95℃以上に加熱すると針状で不安定な単斜硫黄になります。
これらの硫黄を高温で熱して融解させ、
水に注いで急激に冷やすとゴム状硫黄になります。
ゴム状硫黄には結晶構造はなく、
Sが連続的につながった高分子となり、
常温では徐々に安定な斜方硫黄に変化します。
ゴム状硫黄は長らく褐色だと思われてきましたが、
近年日本の高校生が黄色のゴム状硫黄を作り、
低純度で褐色、高純度で黄色になることがわかりました。
以上を表にまとめると以下のようになります。
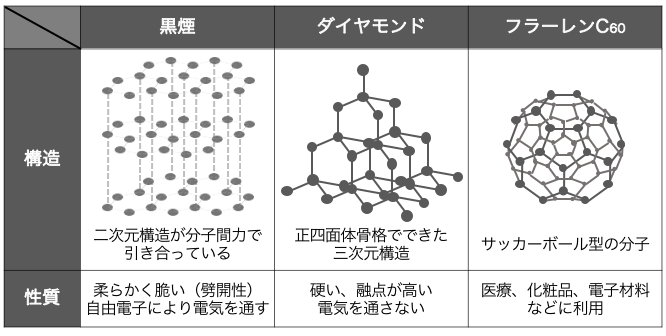
②炭素C
炭素Cの同素体には、
⚫︎黒鉛C – いわゆる鉛筆の芯
⚫︎ダイヤモンドC – 極めて硬い結晶
⚫︎フラーレンC60 – サッカーボール状の分子
などがあります。
黒鉛は鉛筆の芯としておなじみですが、
実はとっても面白い性質があります。
黒鉛は4つの価電子のうち3つで平面構造を作り、
平面同士がファンデルワールス力で引き合います。
そして残った1つの電子を「自由電子」としているのです。
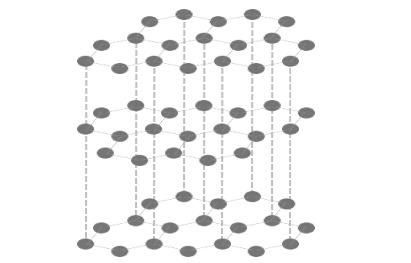
この構造によって一方向にはがれやすく、
自由電子があることで電気伝導性・金属光沢があります。
次にダイヤモンドは、
炭素原子が正四面体状に綺麗につながった構造をとります。
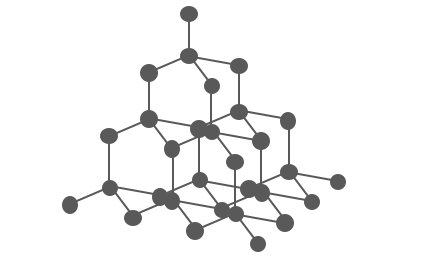
このがっちりした構造によって、
ダイヤモンドは非常に硬いです。
実はダイヤモンドの性質はこれだけではなく、
熱伝導性が非常に高く(銅Cuの5倍!)、
光の屈折率も非常に大きく、
融点約3500℃で単体中最高、
など様々な性質があります。
まさに宝石の王様にふさわしい(?)、
いろんな性質があるのですね。
最後に、近年注目されているのが、
サッカーボール状の分子であるフラーレンC60です。
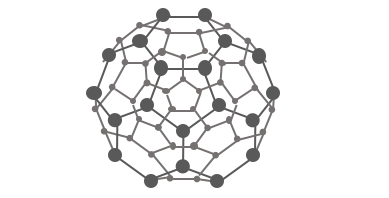
フラーレンは昔から存在に言及はあったものの、
実際に発見されたのは1985年になってからです。
まさに現在利用開発が進められています。
③酸素O
酸素Oの同素体には、
⚫︎酸素O2 – 空気中に含まれる
⚫︎オゾンO3 – オゾン層のやつ
があります。
酸素O2はもはや説明する必要はないでしょう。
生物にとってはなくてはならない気体で、
空気中に存在して、助燃性があります。
電気伝導度の高いO同士の分子で反応性が高く、
高校化学ではおなじみの物質です。
オゾンO3も「オゾン層」で有名で、
紫外線を吸収する性質があります。
淡青色・特異臭の気体で、酸化作用も強いです。
実験室では、酸素O2の無声放電によって得られます。
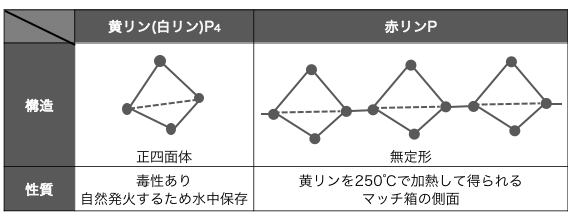
④リンP
リンPの同素体には、
⚫︎黄リン(白リン)P4 – 毒性が高い
⚫︎赤リンP – マッチの側面にあるやつ
があります。
黄リンはリンPが正四面体状につながった分子で、
その構造の不安定さから、60℃程度で自然発火してしまいます。
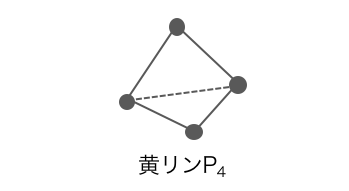
さらに毒性も非常に強いです。
そのため保存方法に気をつける必要があり、
二硫化炭素CS2などの有機溶媒には可溶なため、
水中に保存します。/p>
赤リンは黄リンが次々とつながったような分子で、
分子量が大きく二硫化炭素CS2に溶けません。
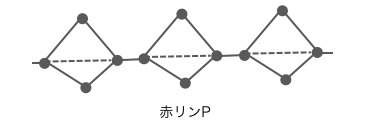
安定性が高く毒性もないため、
マッチの側面に発火剤として塗られています。
同素体まとめ
今回紹介したSCOPの同素体をまとめると、
以下の通りです。
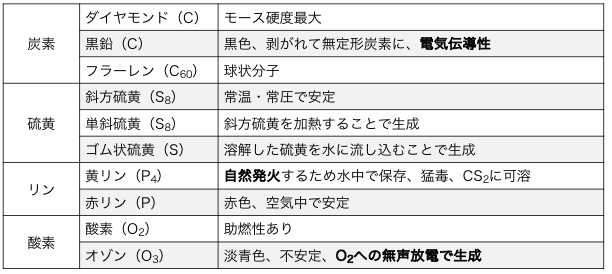
それぞれの物質の個性が強いので、
比較的頭に残りやすいと思います。
参考:その他の同素体
高校レベルのSCOP以外にも、
セレンSeやホウ素Bなど、同素体をとる物質はたくさんあります。
ここでは今回取り上げなかった金属の同素体として、
「鉄の同素体」を少しだけ紹介します。
鉄は体心立方格子の結晶で、
通常「フェライト」と呼ばれます。
しかし、実は、
これは911℃以下の低温の場合のみです。
鉄を強く熱して911℃〜1392℃の間にすると、
面心立方格子である「オーステナイト」になります。
このように、
金属結晶の結晶格子が違うことによっても、
同素体が生じるのですね。
そして1392℃以上まで上げれば、
再び体心立方格子となり、これを「デルタフェライト」と呼びます。
結晶格子の違いによる同素体も面白いし、
固体が液体になるかのように911℃、1392℃で
構造が変わるのもとっても興味深いですね。
まとめ
今回は同素体の解説でした。
覚えるべき同素体を再びまとめておきます。

同素体は覚えることが多くて大変ですが、
鉄の例からも、とっても面白い分野だとわかると思います。
ぜひ気になる物質は自分で調べてみてください。













コメントを書く