この記事では弱酸・弱塩基の遊離反応について説明します。
弱酸・弱塩基遊離反応は、
酸化還元反応や沈殿生成反応などに比べると、
少しマイナーなイメージがあるかもしれません。
しかし実は、弱酸・弱塩基の遊離反応は、
理論化学の中でも決して外すことができない、
最も重要な反応のうちの1つです。
これを理解せずに受験を突破することはできません。
反応には必ず理由があるのですから、
弱酸・弱塩基遊離反応も仕組みからきちんと
理解していきましょう。
目次
弱酸・弱塩基遊離反応とは
弱酸・弱塩基遊離反応を考える前にまずは、
強酸と強塩基、弱酸と弱塩基の違い
を理解しておく必要があります。
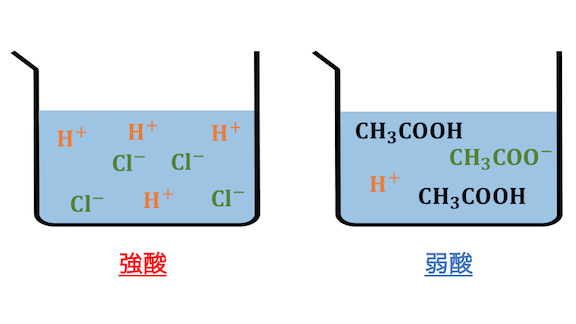
強酸強塩基と弱酸弱塩基
酸のうち、
ほぼ全てが電離してしまう酸を「強酸」、
一部のみが電離する酸を「弱酸」といいます。
言い換えれば、
弱酸は一部のみが電離することで、
平衡状態になっているということですね。
塩基も同様に、
ほぼ全てが電離してしまう塩基を「強塩基」、
一部のみが電離する塩基を「弱塩基」といいます。
遊離反応とは何か
「弱酸遊離反応」とは、
弱酸の塩に対して強酸を加えると、
強酸が電離する代わりに弱酸が分子になる
という反応です。
このように普段電離している酸が分子になることを、
「遊離する」といいます。
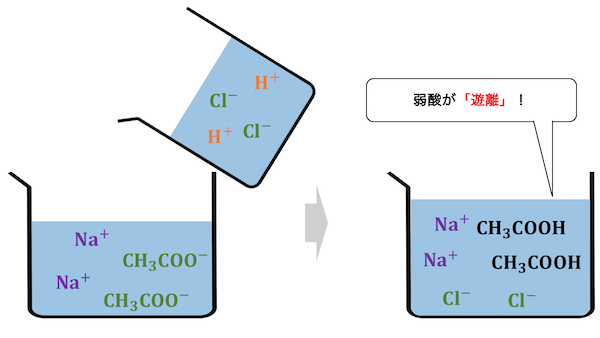
「弱い酸」と「強い酸」と書くくらいですから、
弱酸が溶けているところに強酸がやってきて、
弱酸を追い出してしまうような反応ですね。
また塩基でも同様の反応が起こります。
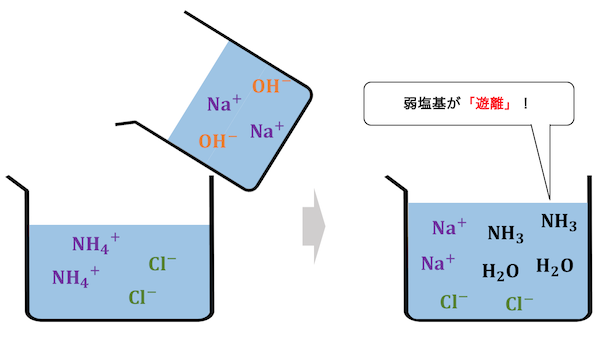
遊離反応が起こる仕組み
さてでは、なぜ遊離反応が発生するのでしょうか?
弱酸・弱塩基遊離反応がなぜ起こるのかを、
仕組みからしっかりと理解していきましょう。
遊離反応を理解するためには、
平衡状態を理解している必要があります。
以下の記事で詳しく説明しているので、
まだ読んでいない方は先に読むことをオススメします。
それでは遊離反応の仕組みを解説します。
弱酸の塩である酢酸ナトリウムCH3COONaに、
強酸である塩酸HClを混ぜた場合で考えてみます。
まず酢酸ナトリウムだけを溶かすと、
溶液中で以下のように電離します。
そして酢酸イオンCH3COO–は、
以下の平衡状態も満たしている必要がありますね。
弱酸である酢酸はどんな場合であっても、
溶液中のH+の量に対応して、
電離するかしないかのバランスを取っています。
しかし酢酸ナトリウムを溶かした状態では、
CH3COO–が供給過多で、
H+がなくなってしまっています。
CH3COO– + H2O ⇄ CH3COOH + OH–
という「加水分解」によってバランスを取っています。
ここに塩酸を入れるとどうなるでしょうか。
CH3COOH ⇄ CH3COO– + H+
塩酸はイオン状態の方が安定だから、
どんどん電離してH+を放出します。
一方の酢酸は、
本来決められた量のH+しか放出できません。
それなのに塩酸が容赦なくH+を放出するので、
ルシャトリエの原理からどんどん左に反応が進んでしまいます。
このように強酸のせいで平衡が左に進み、
弱酸が分子の状態になってしまうのが、
弱酸の遊離反応です。
弱酸・弱塩基の遊離反応は、
強酸(強塩基)と弱酸(弱塩基)の平衡状態の違いから発生する反応だったのですね。
弱酸同士でも遊離反応が起こる?
反応の仕組みがわかれば、
弱酸同士でも遊離反応が起こることがわかるはずです。
2つの具体例で考えてみましょう。
例①:炭酸とフェノール
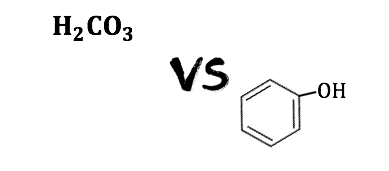
炭酸とフェノールはともに弱酸ですが、
炭酸の電離定数は約\(10^{-7}\)、
フェノールの電離定数は約\(10^{-10}\)と差があります。
つまりフェノールよりも炭酸の方が電離しやすく、
フェノールと比較する場合は炭酸は、
強酸のように扱えるということになります。
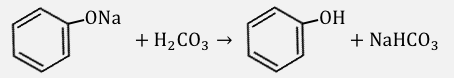
例えばフェノールの塩である
ナトリウムフェノキシドに炭酸を加えると、
以下のような反応が起こります。
例②:炭酸と酢酸
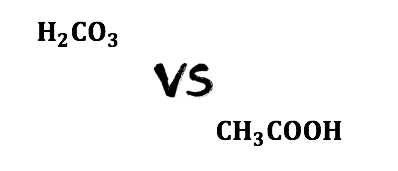
同じように、弱酸である炭酸と酢酸を混ぜるとどうなるでしょうか。
炭酸の電離定数は約\(10^{-7}\)、
酢酸の電離定数は約\(10^{-5}\)です。
炭酸は強酸側として働いていましたが、
今回は酢酸の電離の勢いに負けてしまいます。
例えば炭酸の塩である炭酸水素ナトリウムに
酢酸を加えると以下のような反応が起こります。
これらは有機化学の検出反応として出てきました。
どれも弱酸遊離反応と同じ仕組みだったのですね。
まとめ
今回は弱酸・弱塩基の遊離反応について解説しました。
弱酸・弱塩基の遊離反応の仕組みは、
かなり多くの反応に応用できます。
繰り返し復習しておきましょう。














コメントを書く