あなたは高校化学で登場する、
乾燥剤の性質を理解できていますか?
「乾燥剤はどこまで覚えればいい?」
「なぜ使えない場合があるの?」
こんな風に思っている人も多いでしょう。
あなたが乾燥剤で困ってしまうのは、
乾燥剤の仕組みを網羅的に理解しておらず、
知識がぶつ切りになっているからです。
ここでは乾燥剤について、
仕組みから詳しく解説していきます。
この記事を最後まで読むことで、
乾燥剤を深く理解することができ、
もう二度と忘れることはなくなるでしょう。
乾燥剤に少しでも不安があるあなたは、
ぜひ最後まで読み飛ばさずに読んでみてください。
目次
乾燥剤とは

「乾燥剤」とは、
湿った気体から水分を取り除くためのものです。
気体と水蒸気が混ざった状態から、
うまくH2Oだけを取り出すことで、
気体を乾燥させることができます。
しかし実際はH2Oだけを取り出すことは難しく、
・化学反応を起こしてしまう
・水と一緒に吸収されてしまう
などの現象が起こってしまうのです。
そこで今回は高校化学で必要な乾燥剤について、
その性質や「使いどき」などをまとめて解説していきます。
実験室で気体は、「無機化学の6反応」を利用して作ります。高校化学の気体の製法の反応式は全て、その場で作れるのです。詳しくは以下をチェック。
【合わせてチェック】
・【永久保存版】無機化学の反応はたった6つ!
・さよなら丸暗記!気体の製法まとめ
乾燥剤の分類
先ほども説明した通り、
気体と乾燥剤が化学反応を起こしてしまうと、
目的の気体までもが変化してしまいます。
そして一番起こりやすい反応が「中和反応」です。
酸性の乾燥剤に塩基性の気体を通す、
塩基性の乾燥剤に酸性の気体を通す、
などをすると気体が化学変化してしまいます。
これに注目して、
「酸性乾燥剤」なのか、「塩基性乾燥剤」なのか、
に着目しながら各乾燥剤を見ていきましょう。
①濃硫酸H2SO4
「濃硫酸」は、
高校化学で頻出の乾燥剤・脱水剤です。
硫酸分子は以下のような構造で、
めちゃくちゃに水素結合を起こしています。
ここに水が入ってこれば、
いかにも歓迎されそうですね。
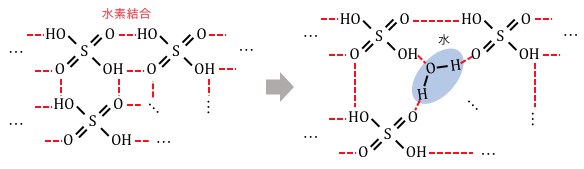
このときの歓迎され具合は、
水を加えたときの溶解熱からもわかります。
濃硫酸と水を混ぜ合わせると激しく発熱し、
一気に水が沸騰してしまうのでしたね。
濃硫酸は酸性乾燥剤ですから、
塩基性の気体(NH3など)には使えません。
また、
濃硫酸(正確には熱濃硫酸)には酸化作用もあるため、
還元剤であるH2Sにも使えません。
これは少し忘れやすいので注意しておきましょう。
②十酸化四リンP4O10
「十酸化四リン」も酸性乾燥剤として使えます。
十酸化四リンは、リンPの酸化物です。
一般に酸化物は以下のように水と反応し、
水酸化物になるのでしたね。
以下のような立体構造をした十酸化四リンも、
水を加えると以下のような反応を起こします。
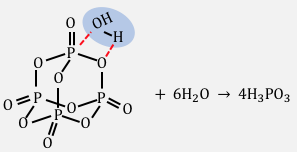
これは通常の酸性乾燥剤であり、
塩基性気体以外には使用することができます。
③塩化カルシウムCaCl2
「塩化カルシウム」は中性乾燥剤として使えます。
中性乾燥剤ということは、
どの気体とも中和反応を起こさないため、
原則すべての気体に使用することができます。
ただし、一つだけ注意が必要です。
強酸・強塩基の塩であるCaCl2は、
酸塩基系の反応は全く起こさないものの、
なんとアンモニアと以下のような付加反応を起こします。
これは知っていないとどうにもなりませんね…。
このようにして、
水とNH3が吸収されるため、
NH3以外の乾燥剤として利用できます。
NH3の吸収同様、水が付加して水和物を作れます。
CaCl2→CaCl2・2H2O→CaCl2・4H2O
→CaCl2・6H2O
④ソーダ石灰(CaO+NaOH)
「ソーダ石灰」は、
CaOやNaOHなどが混ざった塩基性乾燥剤です。
NaOHには「潮解性」があり、
CaOは以下の反応を起こすことができます。
塩基性乾燥剤のため酸性気体には利用できません。
また、
塩基性乾燥剤であるということは、
二酸化炭素CO2を吸収することもできます。
これを逆用すれば、
発生したCO2の量の測定にも使えますね。
乾燥剤とは違う使い方ですが、
これは「有機化学」の中でよく使われるので、
頭の片隅に置いておくといいでしょう。
乾燥剤まとめ
以上の乾燥剤の、
名前、性質をまとめると以下の通りです。
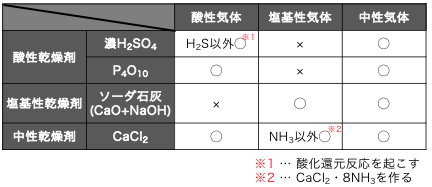
種類を覚えるのは大変ですが、
その性質はほぼ予想できると思います。
ぜひ、
「酸性だから〜」
「酸化剤として働くから〜」
と理由とともに理解しておきましょう。
参考:シリカゲル

「シリカゲル」は、
お菓子の袋の中に入っているなど、
かなりよく使われる乾燥剤です。
基本的には中性乾燥剤(正確には弱酸性)です。
実際の現場ではよく使われる乾燥剤ですが、
試験で問われることは少なめですね。
それにはもしかしたら以下のような、
少しめんどくさい事情があるからかもしれません。
参考:シリカゲルの小ネタを集めてみた
ただし、
乾燥剤としての性質ではなく、
その製法は頻繁に問われます。
二酸化ケイ素からシリカゲルを作る過程は、
意外と複雑なので、以下もチェックしてみてください。
まとめ
今回は、主に気体の収集時に使われる、
乾燥剤の種類と性質をまとめました。

このまとめをスクショして、
繰り返し復習しておきましょう。
また、
乾燥剤は主に気体の製法の部分で現れます。
乾燥剤よりもむしろ、
気体の製法の方が大変に思っていませんか?
でも実は、
気体の製法は丸暗記では決してありません。
気になる人は、
是非以下の記事も読んでみてください。












コメントを書く