「シリカゲルの作り方、手順が多すぎぃ!」
あなたもこんな風に思っていませんか?
確かに、
二酸化ケイ素に水酸化ナトリウムを入れて加熱し、
できたケイ酸ナトリウムに水を入れて加熱して…
なんて考えてしまうと、頭に何も残りません。
シリカゲルの作り方が頭に残らないのは、
各工程の化学反応の意味を理解しておらず、
ただ闇雲に丸暗記しているからです。
ここではシリカゲルの作り方を仕組みから解説していきますね。
ここの内容を理解することで、
シリカゲルの作り方を本質的に理解でき、
一度見れば試験まで忘れなくなります。
ぜひ最後まで読んでみてください。
目次
シリカゲルとは?

「シリカゲル」とは、
お菓子などに入っている乾燥剤のことです。
シリカゲルは多孔質(穴が多い)構造のため、
水を取り込みやすくなっています。
シリカゲルはガラスの原料である、
二酸化ケイ素SiO2から作られています。
以下ではその製法を確認していきましょう。
シリカゲルの製法
シリカゲルの材料となるのは、
二酸化ケイ素SiO2です。
SiO2は天然には石英、水晶などとして存在します。
これからもわかるように、
SiO2は共有結合結晶です。
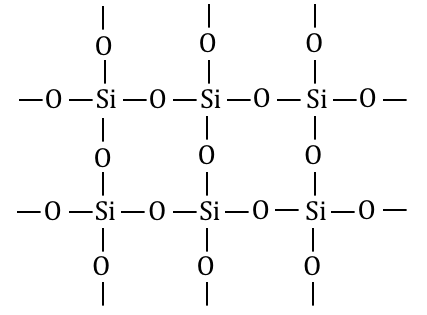
つまりSiO2は分子式ではなく、
組成式であることに注意しましょう。
それではこの構造が、
どのように変化していくのかを見ていきます。
①SiO2からNa2SiO3を作る
まずは「中和反応」を利用してNa2SiO3を作ります。
反応式を先に示しておくと以下の通り。
\mathrm{SiO_{2} + 2NaOH → Na_{2}SiO_{3} + H_{2}O}\]
それでは反応式の作り方です。
中和反応の作り方のところで練習した通り、
SiO2に形式的に水を足し、
NaOHと中和させます。
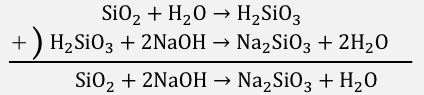
実際に水がSiO2とくっついているわけではなく、
あくまで形式的であることに注意しておきましょう。
実際には固体のSiO2と反応させるため、
「加熱」を行う必要があります。
また、NaOHではなくNa2CO3を使う場合もあります。
\mathrm{SiO_{2} + 2Na_{2}CO_{3} → Na_{2}SiO_{3} + CO_{2}}\]
以上の工程でできたNa2SiO3は以下のような構造です。
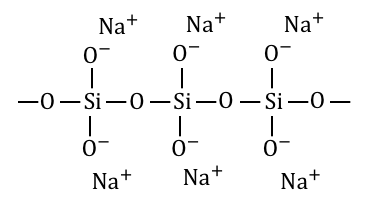
②Na2SiO3を水に溶かす
Na2SiO3に水を加えながら加熱し、
水に溶かしこみます。
ただしNa2SiO3は分子式ではなく組成式で、
分子量が大きいから加熱しないとうまく溶けないのです。
このようにしてできるのが「水ガラス」です。
Na2SiO3は細長い構造で、
水に溶かすとお互いの分子が絡まりあってしまいます。
これによって水ガラスは、
かなり強い粘性を持っています。
③HClを加えてH2SiO3を作る
水ガラスからケイ酸H2SiO3を作ります。
H2SiO3は弱酸ですから、
HClを加えて弱酸遊離反応を起こしましょう。
\mathrm{Na_{2}SiO_{3}+2HCl→H_{2}SiO_{3}+2NaCl}\]
これによって白色のゲル状物質が沈殿してきます。
ケイ酸H2SiO3の構造は以下の通り。
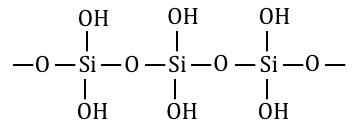
④一部を脱水し、シリカゲルを得る
最後にH2SiO3を加熱して一部脱水することで、
シリカゲルを得ることができます。
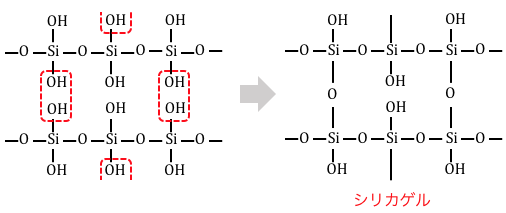
この構造式からわかる通り、
シリカゲルにはたくさんの穴が空いており、
その穴には-OH基があります。
これによってシリカゲルは乾燥剤として働くのです。
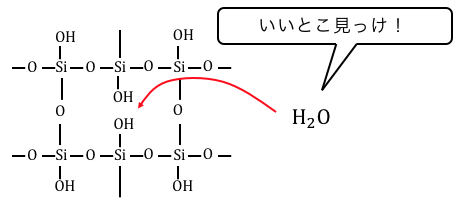
これからもわかるように、
シリカゲルは適度に-OH基が残っていることが重要です。
だからH2SiO3をほどほどに脱水するため、
シリカゲルの化学式は(SiO2)n(H2O)mなどと書かれます。
まとめ
SiO2からシリカゲルを作る流れをまとめると、
以下のようになります。
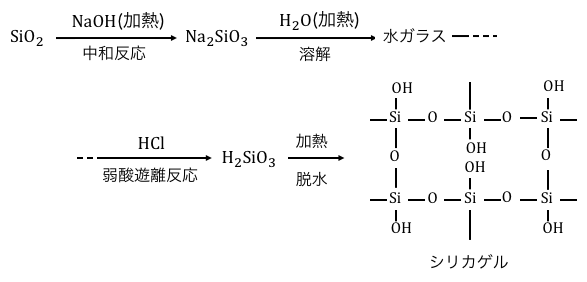
どの工程も特別なことはやっておらず、
すべて無機化学反応を利用しているだけですね。
さらに反応後の構造を意識すると、
それぞれの性質もよくわかると思います。
ぜひこのような「ストーリー」を意識して、
頭に入れておいてください。













46歳のおばさんです。家族が食卓でシリカゲルを撒いてしまったため、犬と乳児がいるので色々とネット検索し、こちらの記事にたどりつきました。
私は大学受験時、化学選択だったのですがすっかり忘れていることばかり。実生活には全く出てこない知識たち、普段ブログにコメントなんてしたことないのですが、とても懐かしくて嬉しくなってコメントさせていただきました!
娘が高1、これから文系・理系の決断に入ります。どうも文系頭なのですが、化学の楽しさを知ってほしいなと思っています(^^)
受験生ではありませんが、またちょくちょく拝見させていただきますね(自分の楽しみのため‥(^_^*)
コメントありがとうございます!
シリカゲルの処理法となると、この記事はあまりお役には立てなかったかもですね(笑)
でも記事を読んでそんな風に思ってもらえるなんて嬉しい限りです。
化学ってとても楽しい科目ですよね!非常に勝手ながら娘さんにも化学を選んでほしいなとか思ってしまいます(笑)
画像をたくさん使った馴染みやすい記事を目指しているので、ぜひ機会があればまた読んでくださいね(^^)