今回は揮発性の酸遊離反応の解説をします。
揮発性の酸遊離反応はとても影が薄いですし、
入試問題として問われるのも珍しいです。
しかしどんな反応であろうとも、
仕組みから理解していないと足を掬われかねません。
試験本番になって、
「あれ、希硫酸だっけ、濃硫酸だっけ…」
「硫酸ナトリウム?硫酸水素ナトリウム?」
なんてことにはなりたくありませんよね。
この記事を読めば、
もう絶対に悩むことはなくなります。
では最後まで頑張っていきましょう。
揮発性の酸遊離反応とは
揮発性の酸遊離反応とは、
HClなどの揮発性の酸の塩に、
H2SO4などの不揮発性の酸を加えて、
揮発性の酸を取り出す反応です。
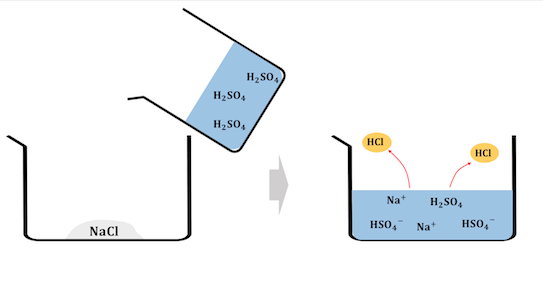
揮発性の酸遊離反応の仕組み
それでは揮発性の酸遊離反応の、
仕組みを見ていきましょう。
揮発性の酸遊離反応の本質的な部分は、
弱酸の遊離反応と同じです。
弱酸遊離反応をまだ理解できていない人は、
以下の記事を先に読んでおきましょう。
希硫酸では反応が進まない
揮発性の酸遊離反応の仕組みを考えるまえに、
「濃硫酸」ではなく、「希硫酸」を使った場合、
を考えてみましょう。
塩酸と硫酸はともに強酸ではありますが、
強酸どうしにも強弱があります。
水素を投げようとしする力は、
塩酸よりも硫酸の方が圧倒的に強いです。
よって弱酸遊離と同じように、
希硫酸が持つH+をCl–に押し付けようとします。
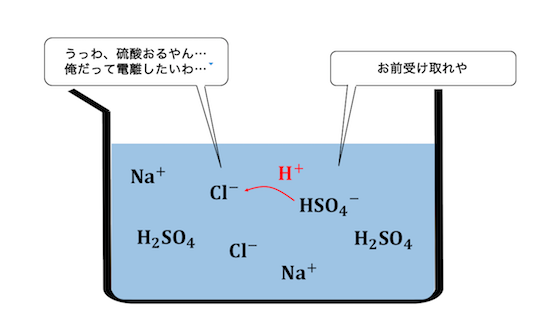
しかし今回の硫酸は希硫酸。
希硫酸は、水で「希」釈した濃「硫酸」なので、
溶液中にはたくさんの水分子があります。
塩酸だって水素を投げる力は強いですから、
硫酸から受け取った水素を水に押し付けてしまいます。
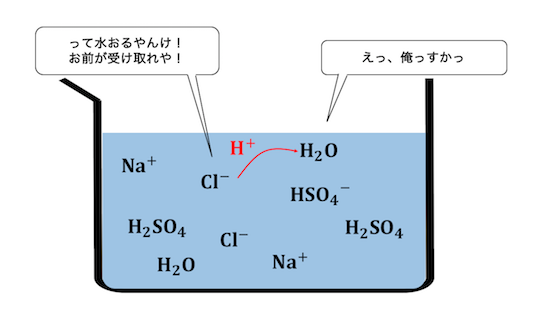
このように、
希硫酸と塩化ナトリウムを混ぜた場合、
「両方普通に溶ける」ということになります。
例)HCl + H2O ⇄ H3O+ + Cl–
このように酸とはH+を他人に押し付ける物質です。
濃硫酸に塩化ナトリウムを加える
では希硫酸に変えて、
「濃硫酸」を使うとどうなるでしょうか。
まずは先ほどと同様、
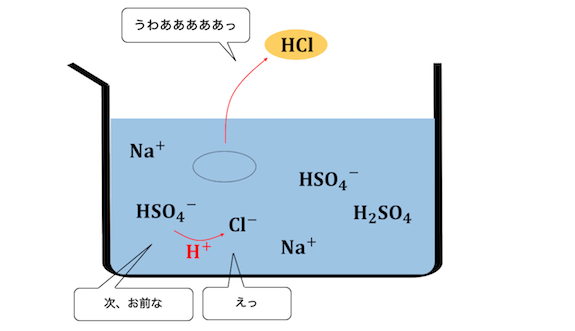
硫酸が塩化物イオンに水素を押し付けます。
このとき、
先ほどとは違って水がほとんどいないので、
塩化物イオンは水素を押し付ける相手がいません。
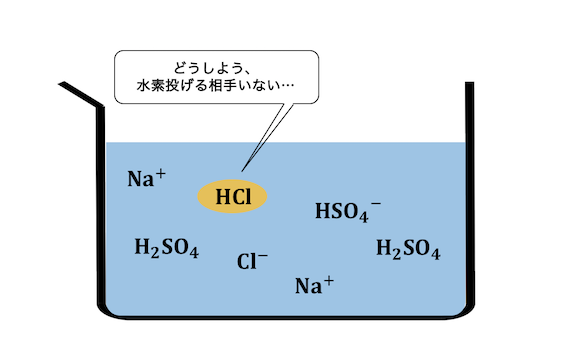
さらに溶液が加熱されているため、
塩化水素は耐えられずに揮発してしまいます。
揮発が進むことで平衡が傾き、
次々と塩化水素が作られていくのです。
以上のように、
弱酸の遊離反応と加熱の合わせ技が、
揮発性の酸遊離反応です。
弱酸遊離の仕組みから考えれば、
2NaCl+H2SO4 → 2HCl+Na2SO4
という反応は起こらないということになります。
濃硫酸は弱酸じゃなかった…?
先ほど、
「塩酸よりも硫酸の方が圧倒的に強い」
と言いました。
それを聞いて、
「でも濃硫酸は弱酸じゃなかったっけ?」
と疑問に思った人もいるでしょう。
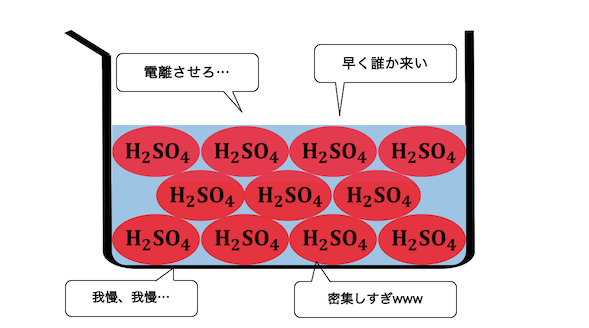
確かに濃硫酸はあまり電離しなく、
水素イオンをあまり放出していません。
しかしそれは、濃硫酸の濃度は98%で、
H+を押し付ける水がいないからであり、
水素を押し付ける力が弱いというわけでは決してありません。
めちゃくちゃ電離したいのにできないという、
非常に欲求不満な状態です。
ここに水素イオンを押し付ける相手がいれば、
もちろん押し付けますよね。
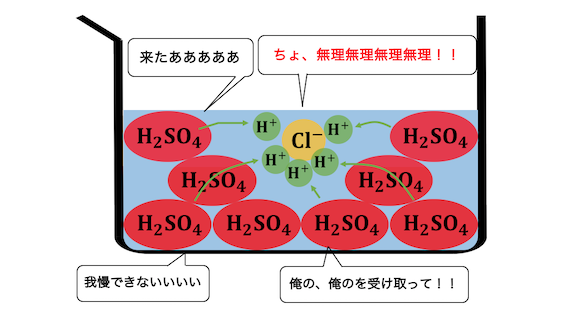
以上のように本質的な酸の強さは、
「どれだけ電離しているか」よりも、
「どれだけ電離したいか」を見ないといけないということです。
押さえておくべきこと
高校化学で覚えておくべき不揮発性の酸は、
濃硫酸のみです。
リン酸も不揮発性ですが、
酸の強さの観点から硫酸を用いるのが普通です。
さらに高校化学での揮発性の強酸としては、
塩酸と硝酸が考えられますが、
硝酸は遊離しても分解されやすいため、
問題として出題されるのは塩酸ばかりです。
結局のところ、
を理解しておけば十分です。
まとめ
今回は学校ではなかなか説明してくれない、
揮発性の酸遊離反応について説明しました。
この記事をここまで読んだなら、
を間違えることはないでしょう。
仕組みを理解しないと間違えやすいところではあるので、不安がある人はきっちりと復習しておきましょう。














コメントを書く