イオン化傾向はセンター・二次の両方で必須の知識です。
しかしなんだかんだ細切れに曖昧に
覚えている人が多いというのが現状です。
この記事ではイオン化傾向とそれに起因する金属の反応を、
入試レベルで過不足なくまとめます。
イオン化傾向をしっかり理解しておくことで、
電池や電気分解はもちろんのこと、
化学全体の理解も深まるでしょう。
どうしても覚えるべきことは多くなってしまいますが、
できるだけわかりやすく説明するのでぜひ最後まで読んでみてください。
イオン化傾向とは
イオン化傾向とは、
「金属の陽イオンへのなりやすさ」
のことを指します。
陽イオンになりやすいというのを言い換えれば、
電子を渡したがっているということですから、
「還元性」が強いということですね。
つまりイオン化傾向が大きいほど反応性が高いということです。
まずはイオン化傾向を並べてみましょう。

このようにイオン化傾向順に並べたものを
「イオン化列」と呼びます。
まずはとにかくこのイオン化列を覚えましょう。
イオン化列の覚え方には有名な語呂合わせがあります。

語呂合わせを覚えた上で何度か紙に書き出し、
確実に覚えるようにしましょう。
金属の反応性
先ほども説明したように、
金属の反応性はイオン化傾向によって決まります。
例えば一番素朴に金属同士の反応を考えます。
例えばイオン化傾向はZn>CuであるのでZnが還元剤として働き、
以下の反応が起こりやすいです。
イオン化傾向が反応を進める例ですね。
ここでは金属同士以外の反応例として、
①水との反応
②酸素との反応
③酸との反応
を確認してみましょう。
まずは表にまとめます。
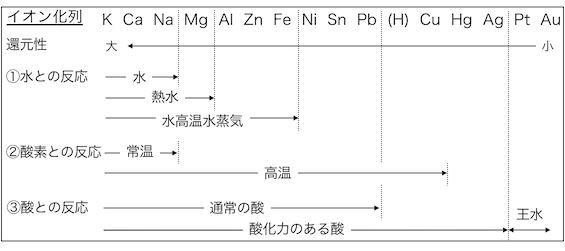
※例外などまで細かく書き込んだ表は最後にまとめてあります。
では個別にみていきましょう。
①水との反応
水は一部が電離してH+が発生しています。
水はイオン積が小さいためその電離度はかなり小さく、
H+の酸化力は弱くなっています。
しかしそれでも、
イオン化傾向が大きい(=還元性が強い)K〜Naは、
H+と酸化還元反応を起こせます。
ただし、高温の水蒸気ならFeまでは反応できます。
この場合は酸化物が生成します。
(例)CuO+H2→Cu+H2O
②酸素との反応
イオン化傾向が大きいものは還元性が強いから、
空気中ではO2と反応します。
常温ではK〜Naまでが、
高温ではK〜Cuまでが反応します。
③酸との反応
水の場合と違って酸性溶液中ではH+濃度が高いため、
Hよりもイオン化傾向が大きいもの、
つまりK〜Pbまではすべて反応します。
イオン化傾向がCu以下のものは通常の酸には溶けませんが、
H+よりも強い酸化力を持つ酸には、
溶ける可能性があります。
これは単に酸化還元反応を思い出せば問題ありません。
つまり、
熱濃硫酸か硝酸に対してはAgまで溶けます。
→AgNO3+H2O+NO2
最後まで溶かすことができなかったAuとPtですが、
濃硝酸と濃塩酸を1:3で混ぜた「王水」には唯一溶けます。
単体の製法
最後に金属の単体の製法も確認しておきましょう。
イオン化傾向の小さいAuとPt以外の金属は、
多くの場合化合物として産出します。
単体を作るためには化合物中の金属イオンを還元する必要があります。
まずAuとPtの次にイオン化傾向が小さいHgとAgは、
単に加熱するだけで還元されます。
次にZn〜Cuまでの元素は酸化物を還元します。
そして最後にイオン化傾向が大きいK〜Alは、
還元が難しいため塩を直接電気分解する「融解塩電解法」を用います。
以上の単体の製法は、
より詳しくは以下も参考にしてみてください。
http://www.jukenmemo.com/chemistry/inorganic/factory-recipe/
(例)Fe2O3+2Al→2Fe+Al2O3
まとめ
最初にまとめたイオン化列に、
単体の製法や例外(不動態など)の情報を加えて、
まとめ直しておきます。
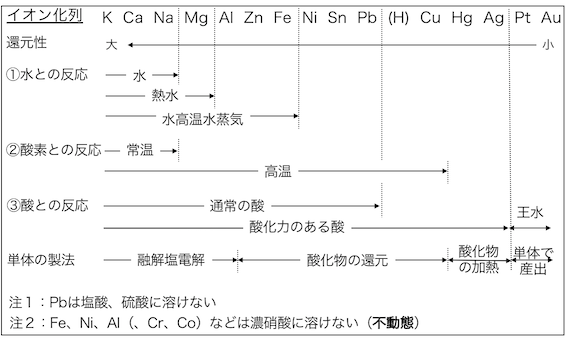
一度腰を据えてきっちりと覚えてみるといいです。
得点にも直結しますし、
それ以降の勉強も楽になるでしょう。













コメントを書く