「置換反応?付加反応?」
「これはアルカンの性質?アルケンの性質?」
有機化学を勉強していて、
このように迷ってしまったことはありませんか?
アルカン・アルケン・アルキンの知識で迷ってしまうのは、
有機化学の本質的な考え方がわかっていないからです。
ここでは本質的な観点から飽和炭化水素を説明していきます。
この記事を最後まで読むことで、
アルカンやアルケンの反応で迷うことはなくなり、
覚えようとしなくても頭に染み付いてしまいます。
有機化学の本質的な考え方が身につき、
理解度の差に驚くことでしょう。
ここの内容を理解するだけで、
今後の有機化学の理解まで深まると思います。
ぜひ最後まで読み飛ばさずに読んでみてください。
目次
アルカンとは
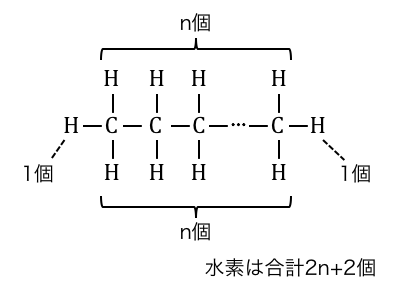
「アルカン」とは、炭素と水素が単結合だけで結合した、
一般式CnH2n+2で表される有機化合物です。
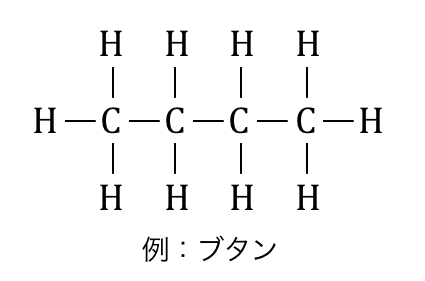
炭素と水素以外に原子はなく、
二重結合も環状構造もない一番基本的な有機化合物ですね。
その構造と反応を見ていきましょう。
アルカンの構造
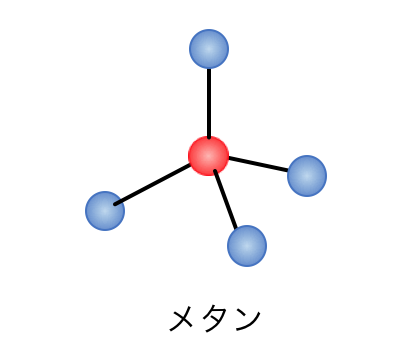
最も単純なアルカンである「メタン」は、
1つの炭素に4つの水素がくっついた、
正四面体形の化合物です。
炭素の数が増えることで、
「エタン」、「プロパン」、…となります。
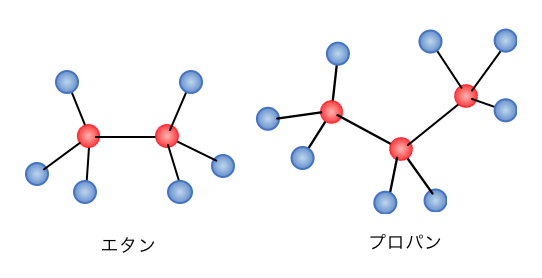
これを見たらわかるように、
アルカンは正四面体形が連続で繋がることで、
ギザギザした形になります。
ただし構造式で書く場合は普通一直線に書いてしまいます。
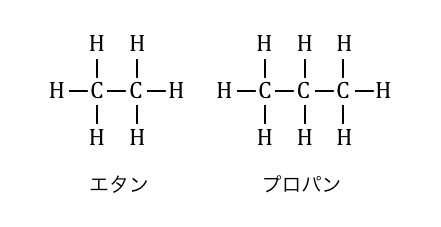
このように構造式を書いてみると、
一般式がCnH2n+2となるのもすぐわかりますね。
アルカンの種類
高校範囲で覚えておくべきアルカンをまとめておきます。
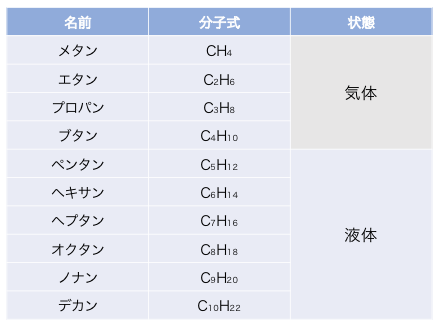
炭素数が増えるほど分子量が大きくなり、
それだけ分子間力が増加します。
ブタンまでは気体ですが、
炭素数が増えて分子が引き合う力が強くなることで、
ペンタン以上はすべて液体になります。
また、炭素数が増えてくると、
同じ分子式であっても形が違う「構造異性体」が出てきます。
構造異性体については以下の記事を確認しておきましょう。
アルカンの反応
アルカンの結合は全て強力な共有結合ですから、
普通は反応を起こしません。
しかし光を当てながら塩素をぶつけることで、
水素と塩素が交換される「置換反応」が起こります。
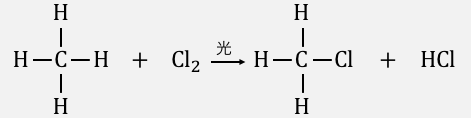
普通は起こりえない反応がなぜおきているのでしょうか?
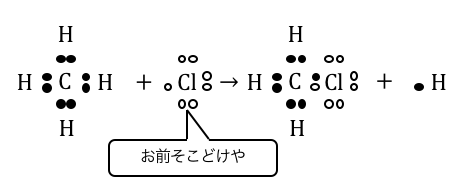
実は塩素に光をあてると、
塩素の電子対のエネルギーと光がうまく噛み合い、
以下のように分解されます。
非常に不安定な塩素原子が、
電子を求めて水素を追い出すことで置換反応が起こるのです。
この塩素原子のように共有結合がバラバラになったものを「ラジカル」といい、
ラジカルによる反応を「ラジカル反応」といいます。
強力なラジカル反応が起こって初めて、
アルカンは置換反応を起こすことができるのですね。
アルケンとは
「アルケン」とは、アルカンの1つの炭素間結合が二重結合になった、
一般式CnH2nで表される有機化合物です。
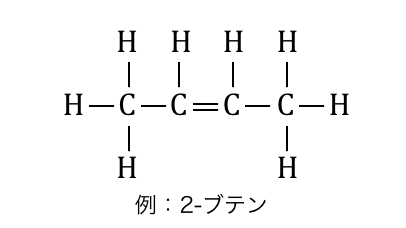
アルカンでは水素に使われていた2つの原子価が、
二重結合として使われるため水素数はアルカンより2少ないです。
アルケンの構造
アルケンの構造を知るためには、
「分子軌道」という概念を知っている必要があります。
「聞いたことない!」という人は以下をチェック!
それではエチレンC2H4を例に考えてみましょう。
エチレンは二重結合を持っていますが、
この二重結合のうちの1つ目の結合は、
以下のように普通の共有結合になります。
このような「普通の共有結合」のことを「σ結合」と呼びます。
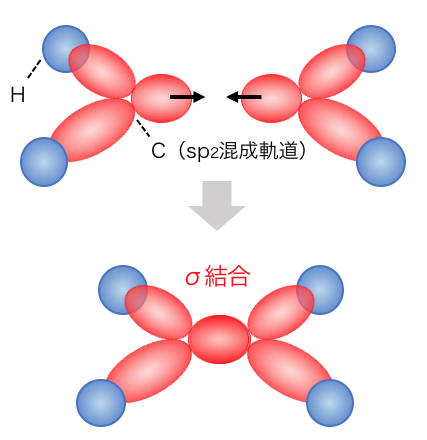
次に2つ目の結合です。
当然炭素をまっすぐに結ぶラインにはσ結合があり、
同じところに結合を作ろうとすれば電子が反発してしまいます。
そこで2つ目の結合は、
p軌道を使って上下に結合を作るのです。
このような結合のことを「π結合」と呼びます。
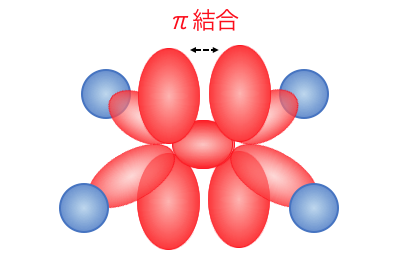
以上からわかるように、
有機化学の二重結合はσ結合とπ結合という、
異なる結合でできているんですね。
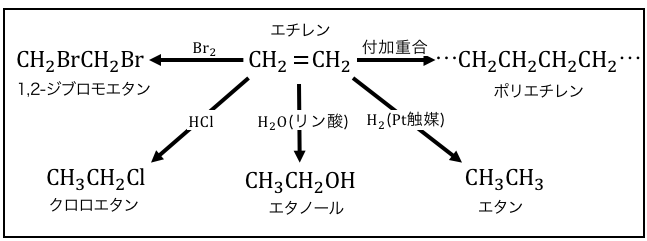
アルケンの反応
アルケンは上下に伸びるπ結合でつながっています。
上下に伸びたπ結合は外から近づきやすく、
とっても無防備です。
つまりこのπ結合を狙った反応が起きやすい、
ということになります。
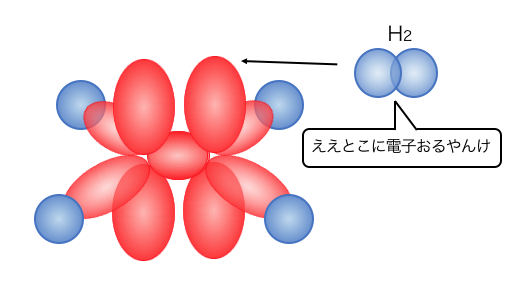
アルケンのπ結合を狙うやつらは、
・ハロゲン
・ハロゲン化水素
・水(リン酸触媒)
・水素(Pt触媒)
・エチレン自身(付加重合)
などです。
こいつらがπ結合に飛びついてくっつくことで、
「付加反応」が起こるのです。
反応の種類は多いですが、
結局のところ電子を欲しがる奴がπ結合を狙っているだけですね。
アルキンとは
「アルキン」とは、アルカンの1つの炭素間結合が三重結合になった、
一般式CnH2n-2で表される有機化合物です。
アルケンと同様に考えれば、
アルカンよりも水素数が4少ないことがわかります。
アルキンの構造
アルキンもアルケン同様まずはσ結合で結合します。
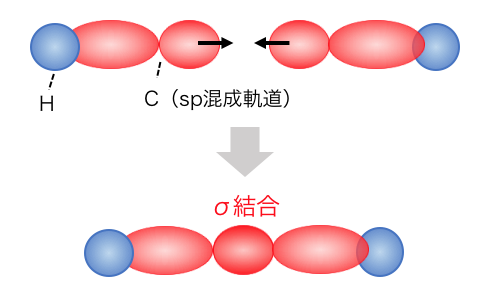
ここに2つのp軌道による結合が起こるわけですが、
当然σ結合の位置には結合は作れず、
p軌道どうしも反発し合います。
その結果以下のように2つのπ結合が作られます。
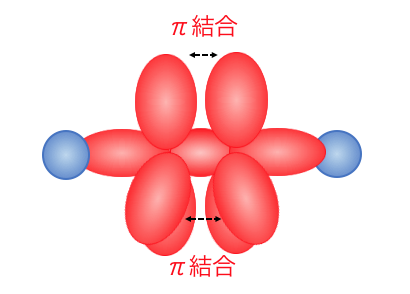
結局のところ多重結合は、
1つのσ結合と複数のπ結合でできているということになります。
アルキンの反応
アルキンの反応も仕組みはアルケンと同じです。
・ハロゲン
・ハロゲン化水素
・水(触媒不要)
・水素(触媒不要)
・酢酸
・アセチレン自身
などがπ結合を狙って攻撃をし、付加反応を起こします。
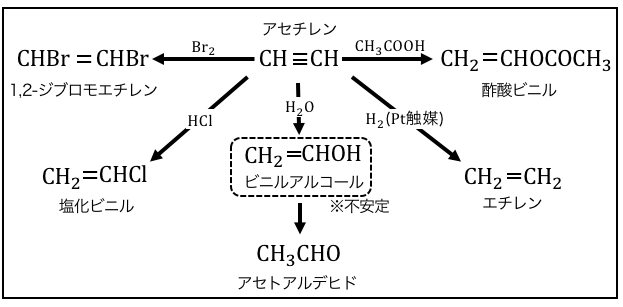
水の付加反応ではCH2=CHOHの形になりますが、
二重結合に-OHがつく形は不安定で即座にCH3CHOになることに注意しましょう。
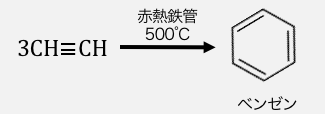
またアセチレン自身が付加重合するとき、
特定の条件で重合させることで以下のようにベンゼンを作ることができます。
いずれにせよアルケンとアルキンの反応の仕組みは全て同じですね。
アルカン・アルケン・アルキンの製法
最も単純なアルカン・アルケン・アルキンである、
メタン・エチレン・アセチレンに関しては製法が問われる場合もあります。
ここで一度確認しておきましょう。
メタンの製法
カルボン酸塩が熱分解により炭酸塩になりやすいことを利用し、
以下の熱分解反応でメタンを生成します。
合わせてチェック:熱分解反応!世界一わかりやすくまとめてみた
エチレンの製法
エチレンはエタノールの脱水によって生成されます。
アセチレンの製法
アセチレンは炭化カルシウム(カルシウムカーバイド)に水を加えて生成されます。
アセチレンから水素が電離するとすると、
その電離定数は10-25と非常に小さいです。
そんなめちゃくちゃ弱い弱酸の塩CaC2に、
それよりも随分電離定数の大きい水を入れることで、
「弱酸の遊離反応」によってアセチレンを生成しています。
合わせてチェック:さよなら丸暗記!気体の製法まとめ
まとめ
今回はアルカン・アルケン・アルキンの解説でした。
アルカンはσ結合のみからなる炭化水素化合物、
アルケンとアルキンはπ結合によって二重結合、三重結合を作るのでした。
π結合がないアルカンを反応させるには、
「ラジカル反応」を利用して置換反応を起こすしかなく、
π結合を持つアルケンとアルキンは、
電子を欲しがるやつを入れることで、
付加反応を起こせるのでした。
アルケンとアルキンの反応には多少種類があるので、
もう一度ここにまとめておきます。


有機化学は覚えることが多いですが、
本質的に理解していけば納得感を持ってすすめられます。
ぜひ他の記事も読んでみてください。














コメントを書く