今回は原子軌道の形について解説します。
原子軌道は高校では習わないので、
「そもそも原子軌道ってなに?」
「原子軌道の形を知って何になるの?」
と感じるかもしれません。
しかし原子軌道の形は、
有機化学をしっかりと理解するために、
非常に重要な概念です。
ここでは原子軌道についてわかりやすく説明しますね。
ここの内容を理解することで、
有機化学の反応の仕組みを理解することができ、
有機化学のわずらわしい暗記が驚くほど楽になります。
楽をするために苦労する、
そんな気持ちで読んでみてください。
目次
原子の構造ってどうなってる?
原子の構造がわかっていなかった時代に、
「ボーア」が原子のモデルを提案しました。
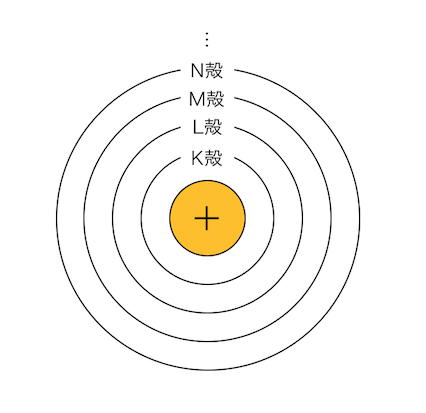
電子が電子殻を回っているというモデルです。
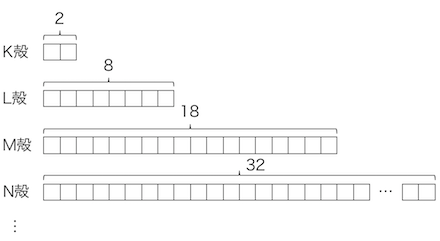
K殻、L殻、M殻、…という電子の「部屋」に、
電子が順番に入っていくという考え方です。
しかし、その後も研究を進めると、
電子殻よりももっと小さな「部屋」があることがわかりました。
電子殻よりも小さな電子の「部屋」のことを、
「軌道」と呼びます。
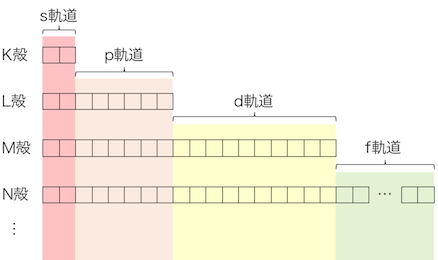
より詳しい軌道の説明は以下の記事にまとめました。
ここから先は、以下の記事で説明した、
1s軌道、2s軌道、2p軌道、…
などの言葉を使っていくので、
これらがわからない人は以下を先に読むことをおすすめします。
軌道の形
電子殻は電子が原子核の周りを公転しているモデルでした。
では軌道はどのような形をしているのでしょうか?
軌道の形はs軌道、p軌道、d軌道、…の、
軌道の種類で変わってくるので、
順番に確認していきましょう。
s軌道の形
まずはs軌道です。
s軌道は以下のような形をしています。
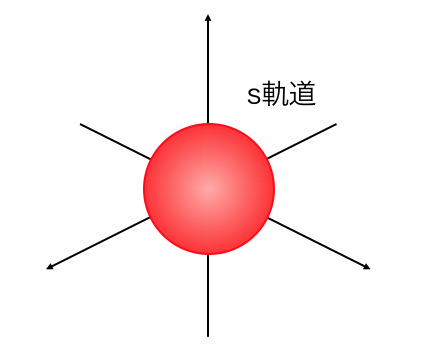
s軌道はこのような球の形をしています。
s軌道の電子はこの球の中を、
自由に動き回っているようなイメージです。
今までの電子殻のように円周を回っているのではなく、
この球の中のどこかに電子がいる、という感じです。
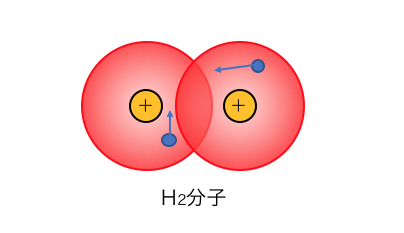
水素原子Hは1s軌道に電子が1つ入った原子ですが、
水素原子同士は1s軌道がくっつくことで分子を作ります。
p軌道の形
次にp軌道の形です。
p軌道は3つありましたが、
3つのp軌道で微妙に形が違います。
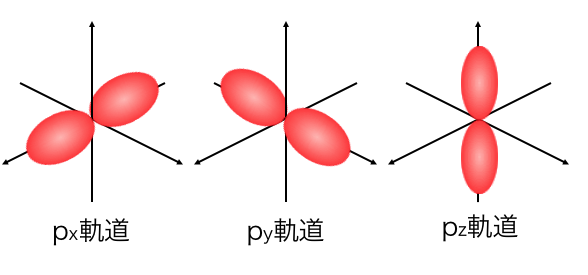
p軌道はこのような8の字の形をしており、
s軌道のときと同じように電子が動き回っています。
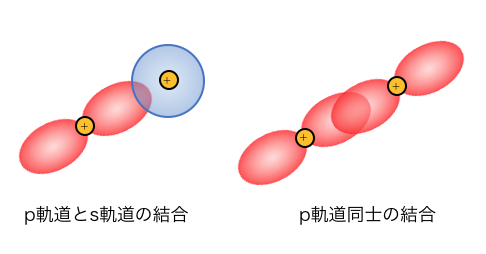
このp軌道どうしが近づいたり、
p軌道とs軌道が近づいたりすると、
水素のときのように共有結合を作ります。
参考:d軌道以降の軌道の形
d軌道以降にも当然軌道の形はありますが、
ここでは触れないことにします。
高校化学の範囲ではp軌道までの形がわかれば十分だからです。
たとえばd軌道は5つ軌道がありますが、
それぞれかなり驚きの形になります。
(気になる人はググってください)
高校では有機化学で使われるC、H、Oがわかればよく、
これらはすべてp軌道までしか使っていないので、
わざわざ複雑なd軌道には触れなくてもいいわけです。
そもそも軌道は「量子力学」の方程式を解くことで発見されました。つまり軌道は方程式の答えとして数式でわかり、それを図示すれば形がわかります。
混成軌道
これで基本的な軌道の形はわかりましたね。
ここからは有機化学をよく理解できるように、
「混成軌道」と言う考え方を紹介します。
炭素Cを例に考えてみましょう。
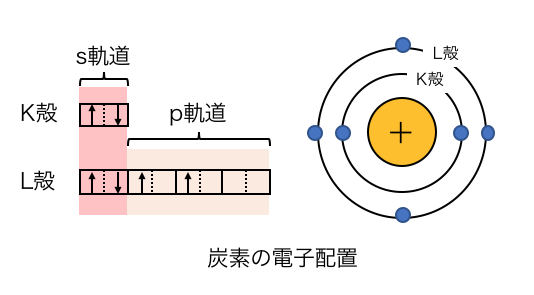
炭素は2s軌道に2つ、2p軌道に2つ電子があります。
つまり炭素の4つの原子価は性質が違うはずですが、
ダイヤモンドやメタンなどを見ると4つを区別できません。
以上を踏まえると、
2s軌道と2p軌道が混ざって新しい軌道ができている
と考えると話がうまくいくわけです。
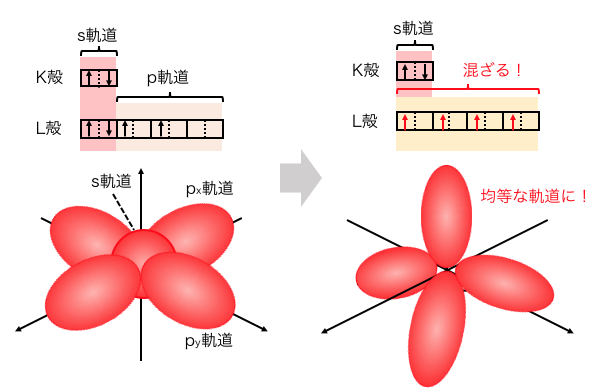
これが混成軌道の考え方です。
混成軌道にはいくつか種類があるので、
順番に紹介していきます。
sp3混成軌道
先ほどの例のように、
2s軌道と3つの2p軌道が混ざってできるのが、
「sp3混成軌道」です。
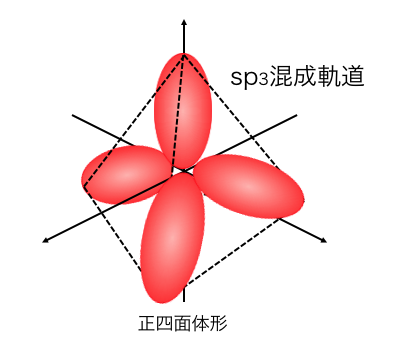
メタン、ダイヤモンドなどはsp3混成軌道による結合です。
sp2混成軌道
2s軌道と2つの2p軌道が混ざってできるのが、
「sp2混成軌道」です。
1つの2p軌道は自立して働き、
残りの軌道が混ざってしまうような混成軌道です。
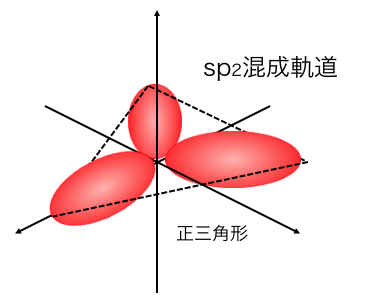
例えばエチレンは二重結合を持っていて、
1つのp軌道が二重結合に関わっています。
そんなときに他の軌道が混ざって、
sp2混成軌道ができるのです。
sp混成軌道
2s軌道と1つの2p軌道が混ざってできるのが、
「sp混成軌道」です。
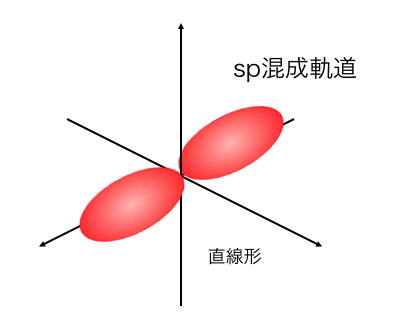
例えばアセチレンは三重結合を持っていて、
2つのp軌道が三重結合に関わっており、
残りの軌道が混ざるのがsp混成軌道です。
参考:有機化合物の結合
「軌道の形がわかったからなんだってんだ!!」
「混成軌道ってなんなんだ!!」
なんて思っているあなたのために
少しだけ有機化学の説明もしておきましょう。
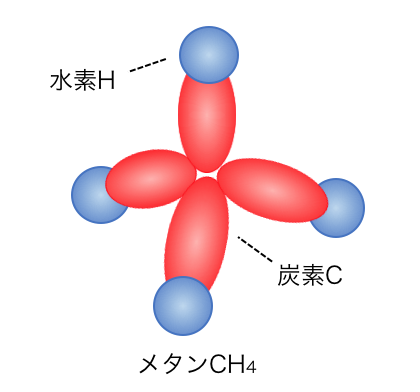
さきほどのsp3混成軌道を見ると、
これはそもそもメタンと同じ形をしていますね。
炭素のsp3混成軌道に水素が共有結合することで、
メタンができているのです。
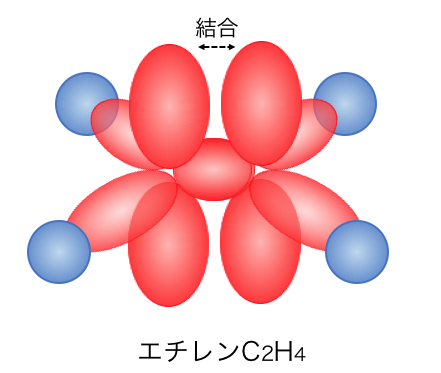
次にエチレンです。
エチレンは炭素のsp2混成軌道に、
水素がくっついた形をしています。
そこに残ったp軌道が関わることで、
二重結合を持ったエチレンができます。
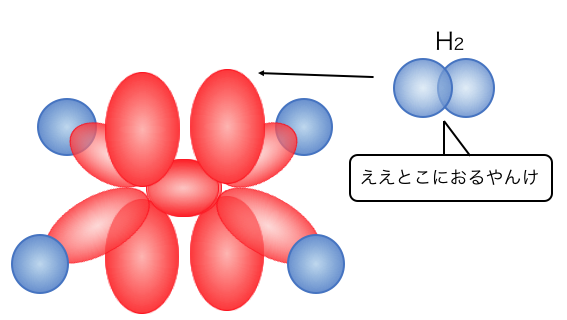
これからもわかるように、
実は二重結合の2つ目の結合は、
上下に広がるp軌道の結合だったんですね。
もし片方の炭素が回転したら二重結合が切れてしまう、
というのもわかりますね。
さらに上下に無防備に電子があるので、
電子を欲しがるやつらの標的にもなりやすいです。
このように軌道を理解することで、
有機化学の反応の理由がわかってくるのです。
まとめ
今回は軌道の形についての解説でした。
s軌道は球、p軌道は8の字の形をしており、
炭素などは混成軌道を作って結合するのでした。
これをなんとなくでも知っておくことで、
この先有機化学がとっても楽しくなると思います。
他の記事もぜひ読んでみてくださいね。














コメントを書く