構造異性体、幾何異性体、光学異性体。
有機化学で出てくる異性体は、
似た名前のものが多くて混乱しやすいです。
学校ではまとめて習うのではなく、
化合物を習うごとにバラバラに習うので、
頭の中がごちゃごちゃになりがちです。
しかし異性体を理解していないと、
単に異性体を答える問題がわからないだけでなく、
有機化学の構造決定問題を解くことができません。
ここでは異性体を整理して解説します。
ここの内容を読めば、
今までぐちゃぐちゃになっていた異性体の知識がまとまり、
異性体の問題で確実に得点できるようになります。
それでは解説していきますね。
目次
異性体とは
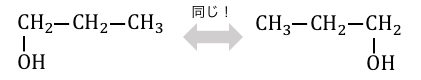
「異性体」とは、分子式が同じなのに構造式が異なるもののことです。
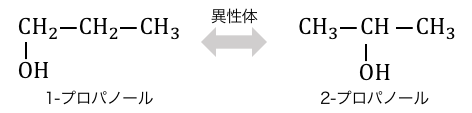
この例の場合は両方同じ分子式C3H8Oなのに、
ヒドロキシ基-OHの付いている場所が違いますね。
この場合は-OHの場所が違うだけですが、
実際にはさまざまな異性体の種類があります。
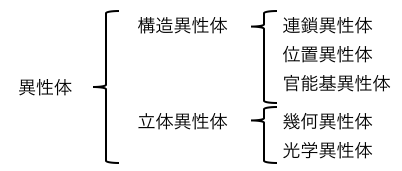
こうやってまとめてみると、
意外と種類があるのです。
学校で習う場合はアルカンのところで構造異性体、
アルキンのところで幾何異性体、構造決定で光学異性体、
というふうにバラバラに習うのでまとまって理解していない人が多いです。
一度まとめて確認しておきましょう。
構造異性体
「構造異性体」とは、分子式が同じでも結合の形が違うもののことです。
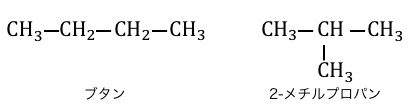
ブタンの端っこの-CH3を引き抜き、
左端から2番目の炭素の-Hと交換し、
-CH3のいたところに-Hを戻しただけなので分子式が一緒なのはわかりますね。
結合の形が違うというのはそういうことです。
構造異性体をさらに分類すると、
・連鎖異性体:炭素骨格が違うもの
・位置異性体:官能基の位置が違うもの
・官能基異性体:官能基自体が違うもの
などがあります。
順番に確認していきましょう。
連鎖異性体
構造異性体のうち炭素骨格が違うものが連鎖異性体です。
例えば炭素数5であるアルカンのペンタンは、
以下のような連鎖異性体を持ちます。
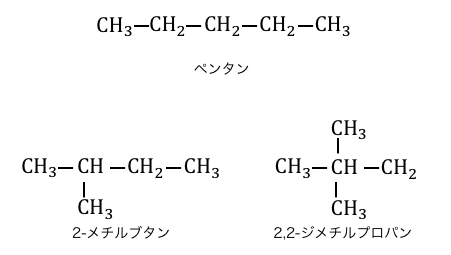
ただし、連鎖異性体は慣れるまでは間違えやすいです。
例えば以下の2つの場合を見てみましょう。
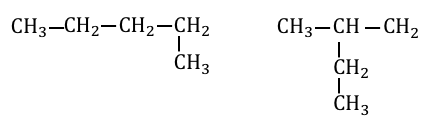
1つ目の場合は右端から-CH3を引き抜いて、
結局元の場所に戻してしまっていますね。
よってこれらは同じものになります。
また、2つ目の場合は、
右端から-CH2CH3を引き抜いて真ん中の炭素にくっつけています。
一見正しそうですが、実はこれは以下の構造と同じです。
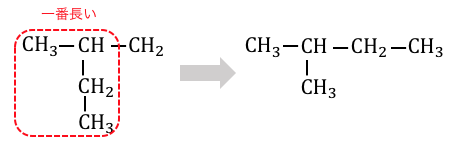
炭素数3の直線に-CH2CH3をくっつけたつもりが、
結局炭素数4の直線に-CH3をくっつけた形になってしまっています。
このように連鎖異性体を考える場合は、
常に「一番長い直線はどこか」に気をつける必要があるのです。
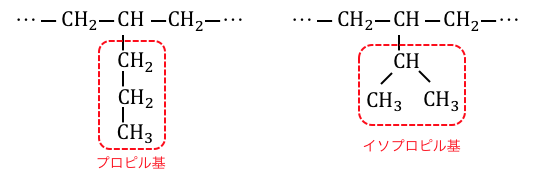
ただしアルカンを考える中でプロピル基が登場するのは炭素数10のデカンからなので、あまり気にしなくても大丈夫です。
位置異性体
構造異性体のうち、官能基の位置が違うものを位置異性体と言います。
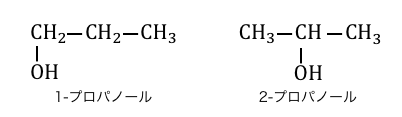
位置異性体は、連鎖異性体に対して順番に官能基を付け替えていけば問題ないでしょう。
ただし、以下のような場合は左右を入れ替えれば同じものになってしまうことに注意です。
官能基異性体
構造異性体のうち、官能基自体が違うものを官能基異性体といいます。
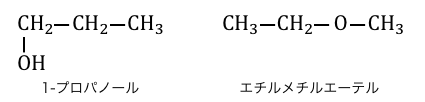
参考:ベンゼンの構造異性体
ベンゼンには以下のような構造異性体があります。
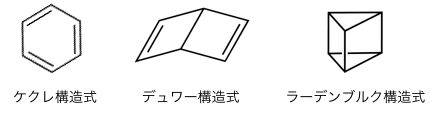
これらは上で分類したどれにも当てはまりませんね。
このように上の分け方はあくまで頭の整理のためで、
全てを網羅しているわけではないことに注意しておきましょう。
立体異性体
「立体異性体」は、分子式は同じなのに立体的な構造が異なる異性体です。
立体異性体には「幾何異性体」と「光学異性体」があります。
それぞれ性質が全く違うので、
それぞれ順番に見ていきます。
幾何異性体
幾何異性体は、炭素二重結合C=Cが回転できないことによって生じる異性体です。
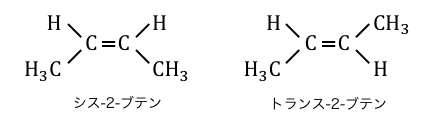
二重結合に対して同じ側に官能基がつくのを「シス」、
二重結合を跨いだ位置に官能基がつくのを「トランス」と言います。
光学異性体
光学異性体のうち鏡像異性体は、
右手と左手のように鏡に写した関係になっている異性体です。
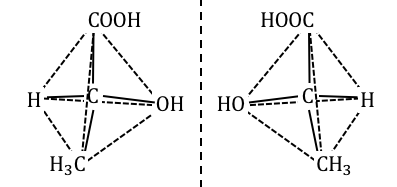
上の例では真ん中の炭素に対して、
4つの異なる官能基がくっついています。
このように4つの異なる官能基が付いた炭素を、
「不斉炭素原子」といいます。
不斉炭素原子がある場合に2種類の光学異性体が生じるのです。
また、不斉炭素原子が2つある場合は、
1つの不斉炭素原子ごとに2種類の異性体があるので、
2×2=4種類の異性体が生じることになります。
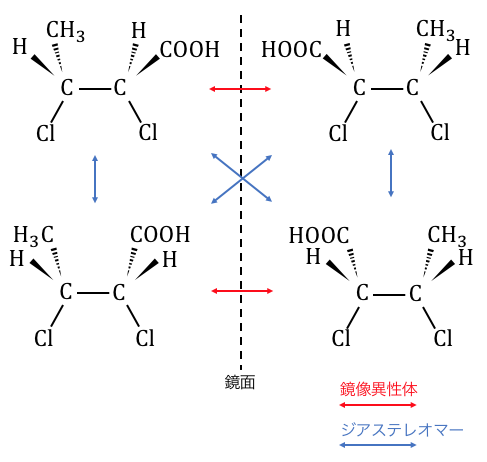
実はこのとき、青線で結んだものは、
光学異性体ではあるものの鏡像異性体ではありません。
このような異性体を「ジアステレオマー」といいます。
名前は全く覚える必要はありませんが、
不斉炭素原子が増えると光学異性体が増えていくことは理解しておきましょう。
例えばグルコースなどの糖類には、
不斉炭素原子が4つありますから、
光学異性体が24=16種類あることになります。
発展:メソ体
発展的な内容として「メソ体」の解説もしておきます。
まだ異性体が曖昧な人は飛ばしてしまって構いません。
さきほど、不斉炭素原子が2つあれば、
4種類の光学異性体があるといいました。
例えば以下のような場合を考えてみましょう。
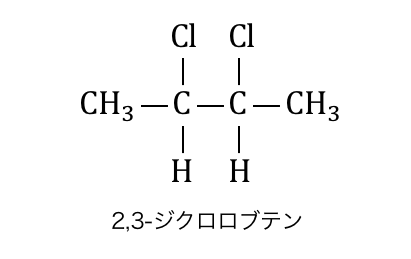
この物質には不斉炭素原子が2つありますが、
不斉炭素原子間の結合の左右が全く同じものです。
このような状態を「分子内鏡面がある」と言います。
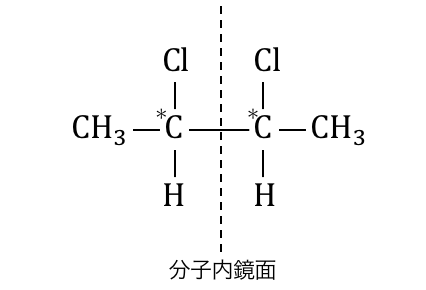
分子の中で構造的に鏡の関係になっているということです。
分子内鏡面がある場合は、
光学異性体のはずが構造が一致してしまうのです。
分子内鏡面によって一致してしまった光学異性体を「メソ体」と言います。
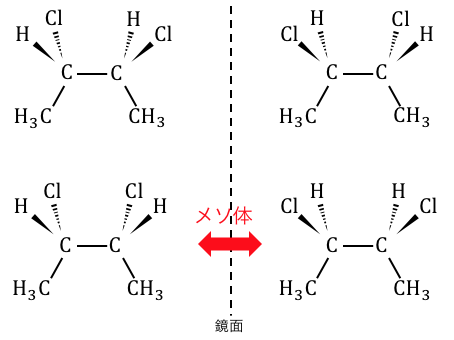
これによって上の物質の光学異性体は3種類になります。
まとめ
今回は異性体の解説でした。
異性体には以下の種類がありました。

異性体を知っておくことは構造決定の問題でも重要になります。
必ずできるようにしておきましょう。














コメントを書く