この記事では溶液中のイオンの検出法をまとめます。
検出法では多くの場合沈殿生成反応を利用します。
沈殿生成反応は反応物や沈殿の色など、
覚えるべきことが多いですね。
そんな暗記量の多い沈殿も、
・陽イオンの系統分析
・イオンの検出法
の2つを学べばほとんど網羅することができます。
今回はそのうち「イオンの検出法」を解説します。
このページだけ読めば大丈夫なようにまとめるので、
ぜひ最後までご覧ください。
陽イオンの検出法
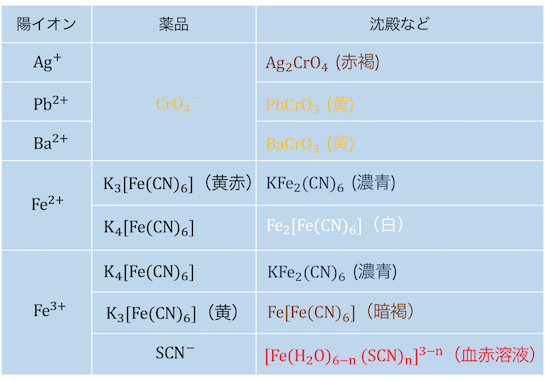
鉄Fe関連の入試で必須のものから、
少しマニアックなものまで合わせてまとめました。
加える薬品と合わせて、
色を中心に覚えていきましょう。
少しだけ説明を加えておきます。
クロム酸イオンCrO4–
系統分析によって金属を分離したのち、
クロム酸イオンを用いて各イオンの存在を確認できます。
例えば塩酸(Cl–)によってAg+、Pb2+、Hg22+が沈殿し、
これを熱するとPb2+のみが溶け、
残った沈殿にNH3を入れるとAg+が溶けます。
これらにそれぞれCrO4–を入れれば、
Ag+ではAg2CrO4の赤褐色沈殿、
Pb2+ではPbCrO4の黄色沈殿が生じます。
これによってPbとAgの存在が確認できました。
また炭酸イオンCO32-によって沈殿したBaCO3は、
塩酸を加えると弱酸遊離反応で再溶解し、
そこにCrO4–を加えれば黄色沈殿となります。
鉄Fe関連
鉄(Ⅱ)イオンFe2+にK3[Fe(CN)6]を加えると濃青色沈殿、
鉄(Ⅲ)イオンFe3+にK4[Fe(CN)6]を加えると濃青色沈殿となります。
一般にこの沈殿は同じものと考えて構いません。
具体的には、
Fe3++K4[Fe(CN)6]→KFeⅢFeⅡ(CN)6
の沈殿生成において、
KFeⅡFeⅢ(CN)6=KFeⅢFeⅡ(CN)6=KFe2(CN)6
とみなせるからです。
またFe3+にチオシアン酸イオンSCN–を入れると、
溶液の色が血赤色になります。
教科書ではFe(SCN)3と書かれたりしますが、
正確には配位子の数はきっちり決まっておらず、
「[Fe(H2O)6-n(SCN)n]3-n(n=1〜6)」という状態になっています。
陰イオンの検出法
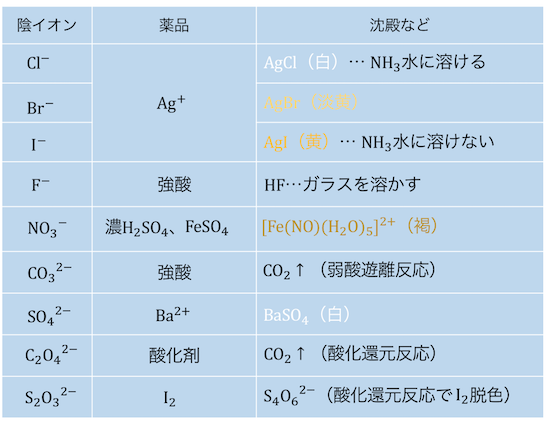
こちらは陽イオンに増してマニアックです。
あくまで参考程度に確認しておきましょう。
ハロゲン+Ag+
フッ素以外のハロゲンは沈殿を作ります。
またAgClはアンモニアを加えると、
錯イオン[Ag(NH3)2]+を作って溶けます。
これらはハロゲンの電気陰性度の差から理解しましょう。
ハロゲンの電気陰性度の大きさは、
F>Cl>Br>Iの順でした。
電気陰性度が非常に強いフッ素Fは、
AgFの状態で極性が強くなり水に溶けます。
AgCl、AgBr、AgIは沈殿しますが、
アンモニア水を加えると次に極性が強いAgClがよく溶け、
AgBrは少しだけ溶け、AgIは溶けません。
まとめれば、
・ハロゲン化銀のうちAgFのみ水溶性
・ハロゲン化銀のうちAgIのみNH3水に不溶
となります。
センター頻出なのできちんと理解して覚えておきましょう。
褐色環反応
硝酸イオンNO3–の検出反応としては、
「褐色環反応」が有名です。
褐色環反応は濃硫酸と硫酸鉄を加えて、
濃硫酸が硝酸イオンを還元して一酸化窒素NOを作り、
鉄との錯イオン[Fe(NO)(H2O)5]2+(褐色)を作る反応です。
参考程度に覚えておきましょう。
その他の陰イオンの検出法
その他の陰イオンは、
無機化学の6つの反応で単純に説明できます。
以下も参考にしてみましょう。
参考:系統分析
溶液中にどの金属イオンがあるかを分析するのが、
金属イオンの「系統分析」です。
系統分析については以下に詳しくまとめたので、
ぜひそちらも見てみてください。
まとめ
陽イオン・陰イオンの検出法を解説しました。
かなりマニアックなものまでまとめましたが、
まとまっているだけでかなり覚えやすいと思います。
もう一度まとめを貼っておきますね。


スクショなどをして何度も確認しておきましょう。














コメントを書く