理論化学のラスボス、化学平衡。
理論化学の中でもイメージが湧きにくい分野です。
それに加えて、
化学平衡の入試問題は難しいものが多く、
ちょっとやそっと理解したくらいでは手がでません。
結局理解できないまま本番に…、
なんて受験生も多いです。
この記事では、
化学平衡を「本質的に」「わかりやすく」説明していきます。
この記事を読めば、
「化学平衡ってそう言うことだったんだ!」
「反応の様子が頭に浮かぶ!」
と言う状態になります。
ぜひ最後まで読んでください。
目次
化学平衡とは
「平衡」とは、
入ってくる量と出ていく量が釣り合うことで、
一見変化していないように見える状態
のことを言います。
お金に例えて考えると、
働いて働いて収入を得ていても、
それと同じ分消費することで貯金が増えないような状態ですね。
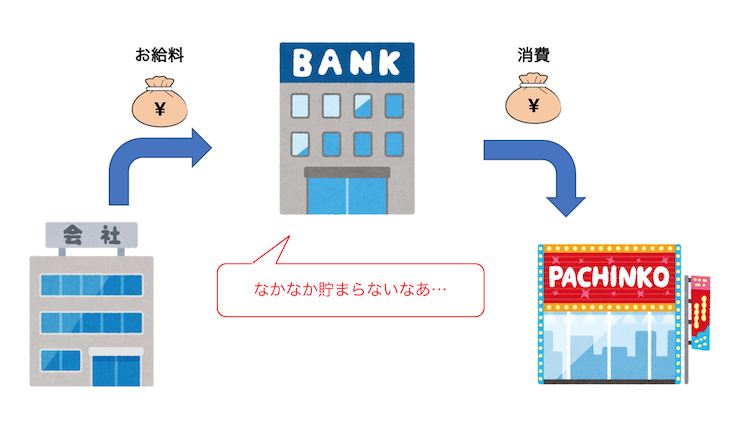
ニートなわけじゃないけど貯金も増えない、
というのが平衡状態です。
化学における平衡状態
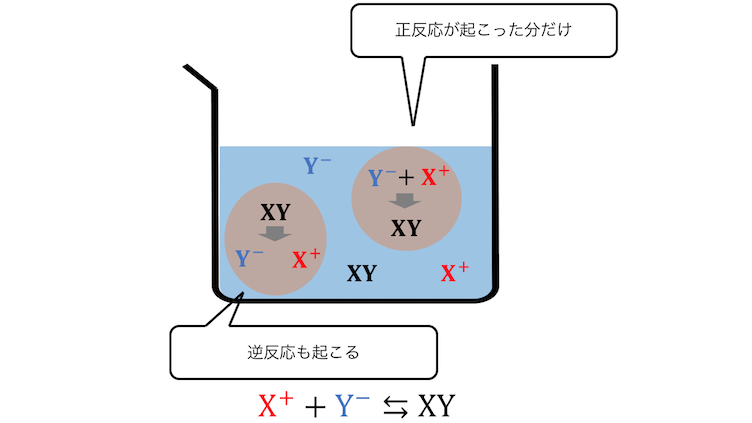
化学における平衡状態とは、
「正反応」と「逆反応」が同時に起こることで、
一見反応が止まって見える状態です。
左側の物質がたくさんあれば、
正反応でどんどん右側に反応が進みます。
逆に、右側に物質がたくさんあれば、
逆反応でどんどん左側に反応が進みます。
左右の物質がちょうどいいくらいの量になると、
正反応と逆反応のスピードが釣り合って、
化学平衡状態になります。
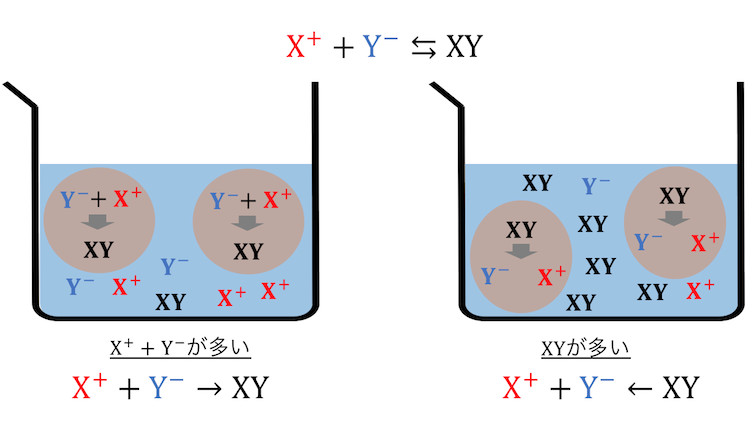
この状態では、
外から見たら反応が起こっていないように見えますね。
化学平衡はなぜ起こる?
貯金が平衡状態のとき、
「働いてお金を得ようとする力」と、
「お金で物を買いたいという力」
の2つがせめぎ合っていました。
では化学平衡はどうして起こるのでしょうか?
化学平衡の仕組みを理解するためには、
「なぜ化学反応が起こるのか」を考える必要があります。
反応の原因①:発熱しようとする力
物理現象は、基本的にエネルギーが小さくなるように動きます。
坂道の途中にボールがあれば、
自然とコロコロ転がりだして、
平らな道で徐々にスピードが落ち、
最後には止まってしまいます。
このように普通はエネルギーが小さくなる方が嬉しいわけです。
化学反応も同じで、
化学反応によってエネルギーを放出できるなら、
よろこんで反応してくれます。
このように、
1つ1つの粒子がエネルギーを放出したい、
と言う力が反応を引き起こします。
反応の原因②:バラバラになる力
透明な水の中にインクを垂らすと、
混ぜなくても徐々に水全体に行き渡ります。
またアロマキャンドルを部屋の隅においても、
時間が経てば部屋全体がいい香りになりますね。
このように、
粒子がたくさん集まると、
できるだけバラバラになろうとします。
この性質によって反応が起こるわけです。
化学で「バラバラになる」とは、
・粒子の数が増加
(例:\( \rm N_{2}O_{4} → 2NO_{2} \))
・より自由に動ける状態へ変化
(例:固体から液体、液体から気体へ)
・より混ざった状態に変化
(例:水にインクを垂らす)
・組み合わせの多様な分子へ変化
(例:\(\rm H_{2}+I_{2} → 2HI \))
などです。
このように、
集まった粒子たちがバラバラになりたい、
という力が反応を引き起こします。
化学平衡が起こる仕組み
このように化学反応には、
① エネルギーを放出しようとする力
② 粒子がバラバラになろうとする力
があります。
この2つの力がせめぎ合うことで、
化学平衡が発生するのです。
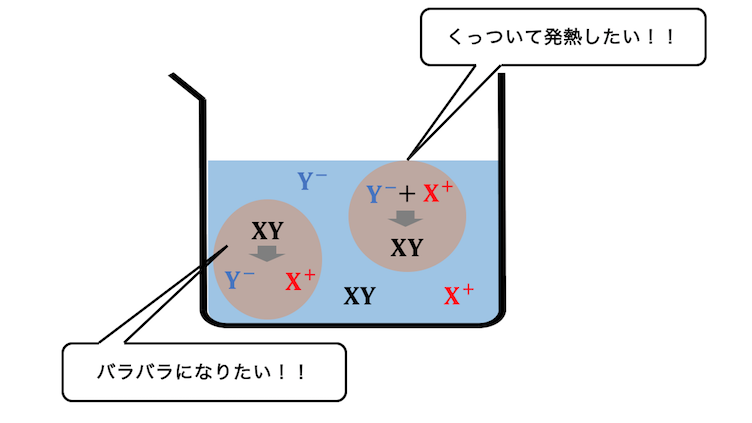
どんな反応にも理由があるのですね。
例外が現れることもあります。
あくまで「原則」として理解しておきましょう。
化学平衡の量的関係
では化学平衡が起こっているとき、
具体的にどんな状態になっているのでしょう。
「平衡状態だ」と言っても、
どのくらい生成物ができていて、
どのくらい反応物のままなのか、
などが気になってきます。
化学平衡状態がどんな量的な関係があるのか、
アンモニアの生成を例に考えていきましょう。
化学平衡の法則
正反応と逆反応が同じスピードで発生することで、
化学平衡状態が発生するのでした。
正反応の速度は、
\(\rm N_{2}\)の濃度が高くなるほど、
\(\rm H_{2}\)の濃度が高くなるほど、
高くなります。
濃度が高いほど分子同士の衝突確率が上がり、
その分、反応が起こる確率も上がるからですね。
つまり正反応の反応速度は、
左辺の物質の濃度に比例している
と言うことになります。
以上から、温度・触媒等を変化させなければ、
と表すことができます。
逆反応の速度も同様に考えると、
となります。
正反応と逆反応の速度が等しいから、
\(\rm v_{正反応}=v_{逆反応}\)を考えると、
\rm k_{正反応}[N_{2}][H_{2}]^{3}&=&\rm k_{逆反応}[NH_{3}]^{2} \\
\rm \frac{[NH_{3}]^{2}}{[N_{2}][H_{2}]^{3}}&=&\rm \frac{k_{正反応}}{k_{逆反応}}=(一定)
\end{eqnarray}
この式から \(\rm N_{2}、H_{2}、NH_{3}\)の濃度が変化しても、
\(K\)の値が一定に保たれるように反応が起こることがわかりますね。
この関係式を「化学平衡の法則」、
もしくは「質量作用の法則」と言い、
\(\rm k_{正反応}/k_{逆反応}=K\)を「平衡定数」と言います。
左辺を\(\rm N_{2}+H_{2}+H_{2}+H_{2}\)で考えてみましょう。反応速度は\(\rm N_{2}\)、\(\rm H_{2}\)、\(\rm H_{2}\)、\(\rm H_{2}\)のそれぞれに比例するから、\begin{eqnarray}\rm v_{正反応}&=&\rm k_{正反応}[N_{2}][H_{2}][H_{2}][H_{2}] \\
&=&\rm k_{正反応}[N_{2}][H_{2}]^{3}
\end{eqnarray}となります。
圧平衡定数
化学平衡の関係を濃度で考えてきましたが、
反応する物質が気体であれば別の見方もできます。
気体の状態方程式から、
\rm P&=&\rm \frac{n}{V}RT \end{eqnarray}
温度\(\rm T\)が一定なら\(\rm RT\)は一定であり、
\(\rm n/V\)が気体の密度(=濃度)なので、
平衡定数を圧力で考えられそうです。
\begin{eqnarray}
\rm [N_{2}]&=&\rm \frac{P_{N_{2}}}{RT}\\
\rm [H_{2}]&=&\rm \frac{P_{H_{2}}}{RT}\\
\rm [NH_{3}]&=&\rm \frac{P_{NH_{3}}}{RT}
\end{eqnarray}
よって、
\begin{eqnarray}\rm
K&=&\rm \frac{[NH_{3}]^{2}}{[N_{2}][H_{2}]^{3}}\\
&=&\rm \frac{\frac{P_{NH_{3}}}{RT}^{2}}{\frac{P_{N_{2}}}{RT}\frac{P_{H_{2}}}{RT}^{3}}\\
&=&\rm \frac{P_{NH_{3}}^{2}}{P_{N_{2}}P_{H_{2}}^{3}}\times (RT)^{-2}
\end{eqnarray}
\(\rm K_{P}=\frac{P_{NH_{3}}^{2}}{P_{N_{2}}P_{H_{2}}^{3}}\)とすると、
\(\rm K_{P}=K\times (RT)^{2}=(一定)\)
濃度の平衡定数\(K\)の代わりに、
\(\rm K_{P}\)で考えることも可能だと言うことですね。
この\(\rm K_{P}\)のことを「圧平衡定数」と呼びます。
ルシャトリエの原理
最後にルシャトリエの原理を解説します。
ルシャトリエの原理とは、
「平衡状態にある系の状態を変化させると、
その変化を打ち消す向きに平衡が変化する」
という原理です。
もっと簡単にいえば、
「変化させたくない!」
という原理です。
もう少し丁寧に説明していきますね。
アンモニアの具体例で考えてみましょう。
濃度が変化した場合
窒素\(\rm N_{2}\)を加えるとどうなるでしょう。
ルシャトリエの原理から、
「変化を打ち消す向きに」
つまり「\(\rm N_{2}\)を減らす向きに」
反応が進みます。
平衡定数でも考えてみましょう。
窒素\(\rm N_{2}\)を加えると、
\(\rm K=\frac{[NH_{3}]^{2}}{[N_{2}][H_{2}]^{3}}\)の分母が大きくなって、
\(\rm K\)が変化してしまいます。
「\(\rm K\)を変化させたくない!」
という力が働き、分母が小さくなる向きへ、
つまり右向きへ反応が進むわけです。
圧力が変化した場合
全体を圧縮して、
圧力を高めた場合を考えてみます。
ルシャトリエの原理から、
「変化を打ち消す向きに」
つまり「圧力を減らす向きに」
反応が進みます。
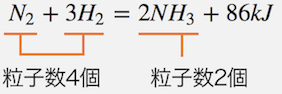
左側の状態だと粒子が4つ、
右側の状態だと粒子が2つなので、
右側の方が圧力を減らすことができます。
よって反応は右に動きます。
「圧力を高い方へ変化させたくない!」
という力が働いています。
こちらは圧平衡定数でも考えてみましょう。
例えば圧力が2倍になったとすると、
全ての気体の分圧が2倍になります。
すると\(\rm K_{P}=\frac{P_{NH_{3}}^{2}}{P_{N_{2}}P_{H_{2}}^{3}}\)の分母は16倍、分子が4倍になって、
\(\rm K_{P}\)全体は小さい方に変化してしまいます。
「\(\rm K_{P}\)を変化させたくない!」
という力が働き、分母が小さくなる向きへ、
つまり右向きへ反応が進むわけです。
「体積が小さくなる」は「圧力が上がる」と読み替えないといけません。
温度が変化した場合
最後に温度を上げた場合を考えます。
まず前提として以下の反応式から、
反応が右に進むほど熱を放出して周りが温まり、
反応が左に進むほど熱を奪って周りが涼みます。

温度を上げた場合、ルシャトリエの原理から、
「変化を打ち消す向きに」
つまり「温度を下げる向きに」
反応が進みます。
「温度を高い方へ変化させたくない!」
という力が働き、反応は左へ進みます。
結局いずれの場合でも、
「変化させたくない!」
という力で反応が進んでいますね。
まとめ
化学平衡は高校化学の最重要な分野、
と言っても過言ではありません。
入試試験の科目としても頻出ですし、
さまざまな化学反応を理解するのにも役立ちます。
しっかりと練習をしておきましょう。














誤植を見つけたかもしれないので確認してほしい
http://www.jukenmemo.com/chemistry/theory/chem-equilibrium/
↑の記事で
ルシャトリエの原理、圧力が変化した場合、という題で
「分母は8倍、分子が4倍になって、」のところで
8倍ではなく、16倍ではないでしょうか
ほんとですね、変な計算ミスをしてました…笑
ご指摘ありがとうございますー、
訂正しておきました!