今回は鉄の製法について説明します。
鉄の製法自体は単純ですが、
不純物の扱いなどが細かく問われます。
さらに鉄の精製の中で出てくる物質の名前も、
覚えておく必要がありますね。
この記事では鉄が作られるまでの流れを説明します。
「なぜその操作が必要なのか」
という理由を重視して説明します。
きちんと理由を理解しながら覚えていくことで、
すんなり頭に入ってくるようになるでしょう。
それでは最後まで読んでみてください。
鉄の製法の仕組み
単体の鉄は、自然界から産出される「酸化鉄(Fe2O3やFe3O4)」を還元して作ります。
鉄に対して還元剤にとなるのが一酸化炭素COです。
COは不安定な物質で二酸化炭素CO2になりたいですから、
酸化鉄から次々と酸素を奪っていく、
というようなイメージです。
鉄の製法の反応式
還元剤となる一酸化炭素を作るため、
まずはコークスCを焼きます。
CO2+C⇄2CO
こうして発生したCOが鉄から次々と酸素を奪います。
一連の反応をまとめると、
「一酸化炭素が鉄の酸素を奪う」
というわかりやすい反応ですね。
直接還元(30〜40%):Fe2O3+3C→2Fe+3CO
間接還元(60〜70%):Fe2O3+3CO→2Fe+3CO2
不純物の処理
実際の鉄鉱石の中には、
二酸化ケイ素(SiO2)、酸化アルミニウム(Al2O3)などの
不純物が含まれています。
この不純物を取り除くため、
コークスとともに「炭酸カルシウム(CaCO3)」を入れます。
これによって不純物を溶かします。
CaO+SiO2→CaSiO3
CaO+Al2O3→Ca(AlO2)2
このように、金属の精錬で出てくる不純物を「スラグ」といいます。
溶けている鉄の密度は約7g/m3、スラグの密度は約3.5g/m3なので、
鉄の上にスラグが浮いてきて簡単に回収できるようになります。
SiO2とAl2O3は融点が高くて鉄が溶ける温度でも溶けません。CaSiO3やCa(AlO2)2は融点が低く、溶けて浮いてくるので回収が楽になります。
実際の鉄の製法の流れ
実際の製法ではより純度の高い鉄を得るために、
少し手順が増えます。
それでは実際の製法を見てみましょう。
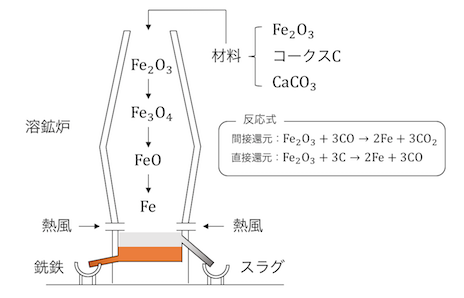
鉄を単離するためのかまどを「溶鉱炉」といいます。
まずは溶鉱炉に鉄鉱石、コークス、炭酸カルシウムを入れ、
先ほど説明した還元反応を起こします。
ここで不純物として「スラグ」が取り除けます。
CaO+Al2O3→Ca(AlO2)2
このようにしてできた鉄を「銑鉄」といいます。
銑鉄は、炭素C・リンP・硫黄Sなどの不純物が約4%ほど含んでいます。
この状態は鉄が固くて脆く、展性・延性も落ちてしまいます。
この不純物を除くために、
溶かした銑鉄を「転炉」に運びます。
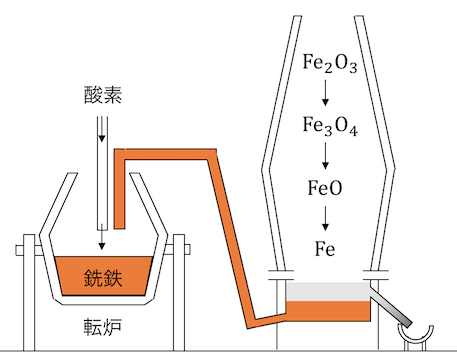
転炉で酸素を吹き込んで不純物を減らし、
炭素量が約2%以下になったものを「鋼」と呼びます。
こうして目的の純度の高い鉄が手に入りました。
まとめ

今回は鉄の製法について説明しました。
「溶鉱炉」で鉄鉱石をコークスとともに焼くことで、
還元反応を起こします。
で同時に炭酸カルシウムを加えることで、
SiO2やAl2O3を「スラグ」として取り除くのでした。
こうしてできた炭素量の多い鉄を「銑鉄」といい、
「転炉」の中で銑鉄に酸素を吹き込むことで、
炭素量が少ない「鋼」を得ます。
以上が鉄の製法でしたね。
このまとめの中で赤字で書いた部分は、
試験で名前を問われる場合もあるので覚えておきましょう。














コメントを書く