今回は硫酸の工業的製法である接触法の解説です。
接触法は工業的製法の中では比較的単純ですが、
全くの丸暗記をしていると足をすくわれてしまいます。
この記事では、
接触法の仕組みや反応式の作り方はもちろん、
接触法が作られる歴史も紹介します。
軽い読み物感覚で読んでもらえればと思います。
目次
接触法とは
「接触法」とは、工業的に硫酸を大量生産する方法です。
錬金術の時代、
「金属を溶かす液体」として硫酸が発見されます。
硫酸の金属を溶かす性質を使えば、
不純物の混ざった銀や金を純度の高い状態にできます。
この性質から、硫酸は錬金術の時代から重宝されてきました。
このことから、
より効率的に硫酸を作る技術が長年研究されてきたのです。
そんな研究の中で発見された大量生産の方法が、
硫黄を燃やすことでできるSO2を触媒のV2O5に「接触」させてSO3を作る接触法。
「なんでV2O5なんてものを使うんだ?」
と疑問に思う人も多いと思いますが、
この触媒が見つかったことこそが接触法のキモなのです。
V2O5を用いる接触法が発明されたのが1915年。
長年の研究の末見つかったこの製法が、
100年以上経った現代でも利用されています。
接触法の流れ
接触法の大きな流れは、
①硫黄Sなどを燃やしてSO2を作る
②V2O5触媒によってSO2をSO3にする
③既存の濃硫酸にSO3を溶かす
④希硫酸を混ぜ合わせる
です。
各段階に分けて見ていきましょう。
①硫黄Sなどを燃やしてSO2を作る
まずは硫黄を燃焼させて、SO2を作りましょう。
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
たまに入試試験でも問われるので注意しましょう。式は複雑ですが通常の燃焼反応です。
②V2O5触媒によってSO2をSO3にする
ここが接触法のキモの部分です。
V2O5触媒にSO2を「接触」させます。
③既存の濃硫酸にSO3を溶かす
SO3を水に解かせば硫酸は作れますが、
その反応はあまりに激しく、溶液が飛び散ります。
そこで一旦濃硫酸に吸収させて、
それに希硫酸を混ぜることで水と反応させます。
④希硫酸を混ぜ合わせる
発煙硫酸に対して希硫酸を混ぜて硫酸をつくります。
発煙硫酸内のSO3と希硫酸内のH2Oが反応して、
まとめ
今回は接触法の説明でした。
接触法は、
①硫黄Sなどを燃やしてSO2を作る
②V2O5触媒によってSO2をSO3にする
③既存の濃硫酸にSO3を溶かす
④希硫酸を混ぜ合わせる
によって、
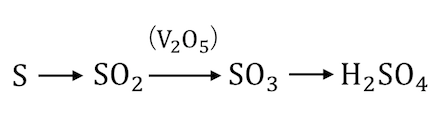
と変化させる方法です。
触媒のV2O5は長年の研究で発見されたもので、
基本的には覚えるしかないです。
時々他の工業的製法と見比べて、
思い出してみましょう。













コメントを書く