今回は銅の電解精錬の説明です。
銅は粗銅を電解精錬することで得られます。
電解精錬とは結局のところ「電気分解」のことで、
本質的には全く難しくありません。
しかし電気分解という理論化学の内容に、
無機化学の内容が混ざって出てくることが多いため、
意外と混乱している受験生が多いです。
この記事では粗銅の電解精錬の解説をしますね。
ここでの内容を理解してきっちり知識を整理すれば、
もう粗銅の電解精錬の問題では満点しか取れなくなるでしょう。
また、粗銅の電解精錬では計算問題が頻出なので、
練習問題もつけておきました。
ぜひ活用してみてください。
銅の製法の仕組み
先ほども言った通り、
銅の製法は単に粗銅を「電気分解」するだけです。
もし電気分解に不安がある場合は、
以下の記事を参考にしてみてください。
まずは陽極に粗銅、陰極に純銅を取り付けます。
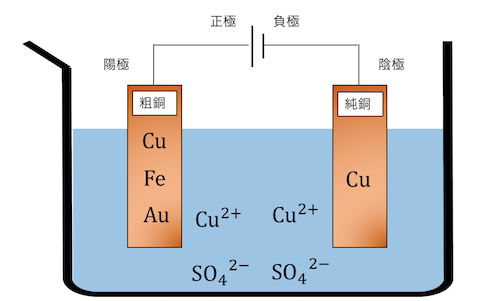
今回の粗銅には、
Fe、Auなどの不純物が混ざっているとします。
ここに電圧をかけて電気分解を行います。
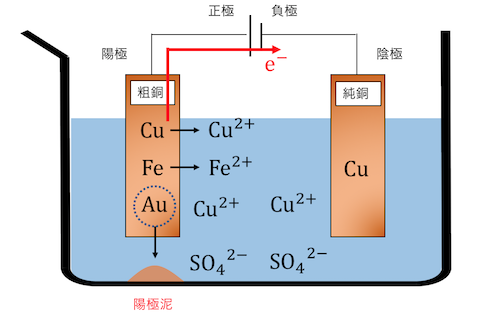
陽極は主に銅でできているため、
電気分解を開始すれば電子を陰極側に投げて溶液中に溶け出します。
ここでイオン化傾向が高いFeも、
銅と一緒に溶け出してしまいます。
Fe→Fe2++2e–
しかしイオン化傾向の小さい金Auは、
当然溶け出すことなどありません。
周りの銅や不純物が溶け出してしまうせいで、
Auなどのイオン化傾向の小さい不純物は、
「陽極泥」として陽極の下にたまります。
そして向かい側の陰極では、
通常の電気分解と同様電子を受け取って、
溶液中のCu2+がCuとなって陰極に付着してきます。
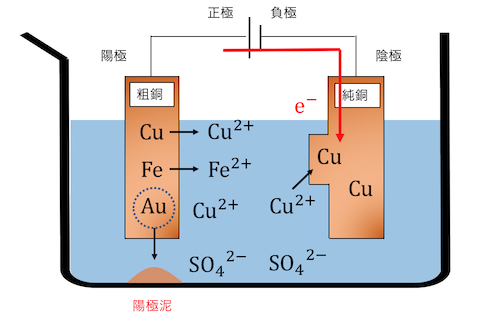
これを続けることで、
陰極に純度の高い銅が溜まっていくのです。
練習問題
銅の電解精錬の意味はわかっても、
実際の問題でミスをしてしまう人も多いです。
ここで一度練習しておきましょう。
不純物として亜鉛、銀、鉛を含んだ粗銅板および純銅板を、硫酸酸性の硫酸銅(Ⅱ)水溶液に浸し、直流電源につないで電気分解を行なった。以下の問いに答えよ(Cu=64)。
(1)粗銅、純銅はそれぞれ電源の正極、負極のどちらに接続すればよいか。
(2)この電気分解で陽極泥になる元素はなにか。
(3)銀だけを不純物として含む粗銅を、0.12Aの電流で602分間電気分解したら、粗銅の質量は1.5g減少した。粗銅中の銀の質量パーセントを求めよ。
この1問が解ければもう電解精錬は完璧!
という問題を選びました。
すぐ下で解説をするので、
一度ここでストップして問題を解いてみましょう。
(1)
溶かしたいのはもちろん「粗銅」。
電池は正極向きに電流が流れる
=正極が電子を吸い込む
となっていますから、粗銅をつなぐのは正極。
逆に純銅は負極に繋ぎます。
(2)
亜鉛、銀、鉛のうち、銀だけはイオン化傾向が小さく溶けません。
亜鉛と鉛は溶け出しますが、鉛イオンは溶液中の硫酸イオンと沈殿生成反応を起こします。
以上から陽極泥になっている元素はAgとPb。
(3)
0.12Aの電流を302分間(=602×60秒)流したとき、
0.12×602×60Cの電子が動く。
ファラデー定数から、
0.12×602×60C ÷ 96500C/mol
≒0.045mol
よって電子は0.045mol動いたことになる。
粗銅では、
Cu→Cu2++2e–
が起こっている。
Cuが1個対して電子2個ができるということは、
電子0.045molの材料になったCuは0.0225mol。
つまり溶け出した銅は、
0.0225mol×64g/mol=1.44g
銅は1.44gしか溶けてないのに、
粗銅板が1.5g軽くなってる!!奇跡だ!!
なんてことはもちろんなく、
その差分がまさに陽極泥としてたまるAg。
よって粗銅1.5gの中に1.5-1.44=0.06g含まれていたということになる。
以上から粗銅中のAgの質量パーセントは、
0.06/1.5×100=4.1666…≒4.2%
粗銅の純度は95.8%だったということになります。
(解答終)
参考:銅の工業的製法
現実に工業的に銅を生産する場合、
まずそもそも「粗銅」を用意する必要があります。
しかし銅は自然界に単体では存在していないため、
天然の鉱物から粗銅を作る必要があります。
試験では問われず、覚える必要はないですが、
一応紹介しておきます。
①天然の鉱物を加熱する
銅の原料として例えば黄銅鉱(CuFeS2)があります。
黄銅鉱とケイ砂とコークスを溶鉱炉内で加熱します。
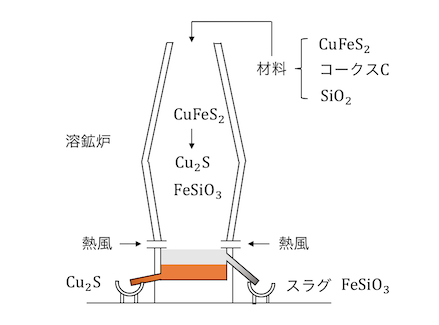
不純物の鉄は「スラグ」として除かれ、
銅の硫化物ができます。
②空気とともに加熱する
銅の硫化物を転炉にいれ、
酸素を吹き込みながら加熱します。
2Cu2O+Cu2S→6Cu+SO2
これによって「粗銅」を手にいれることができました。
③粗銅の電解精錬を行う
最後にこの粗銅を使って電解精錬を行います。
これは先ほどと同じ説明になるので省略します。
鉄の工業的製法を解説!
まとめ
今回は銅の電解精錬について説明しました。
結局のところ、
陰極:Cu2++2e–→Cu
という「電気分解」が起こっているだけでしたね。
このように原理は単純ですが、
計算問題になると苦手意識を持ってしまう人もいるので、
練習問題を活用してみてください。














コメントを書く