「化学の中でも電気分解が特に嫌い」
「電気分解は覚えることが多すぎる」
「せっかく覚えても忘れてしまう」
あなたはこのように感じたことはありませんか?
電気分解の反応をただ闇雲に覚えていっても、
なかなか問題は解けるようにならないものです。
いつまでたっても電気分解が得意にならないのは、
電気分解の本質的な仕組みを理解していないからです。
この記事では電気分解を完璧に理解できるための、
本質的な考え方を説明します。
ここでお伝えする考え方を身につけることで、
もう電気分解の問題を見たときに迷うことはなくなり、
どんな試験問題も解き進められるようになります。
今までと比べて驚くほどスラスラ解けるでしょう。
本質的な仕組みを考えずに反応を覚えても、
少し時間が経てば忘れていってしまいます。
この記事を読んで電気分解の本質を理解しましょう。
目次
電気分解とは
「電気分解」とは、
電池のエネルギーで無理やり酸化還元反応を起こし、
溶液を分解したりする手法
のことです。
電気の力で無理やり分解するから電気分解と呼ぶのですね。
電池は正極(+)側から電子を吸い上げ、
負極(-)側に供給する装置です。
この電池のエネルギーを利用することで、
以下のように電子が動きます。
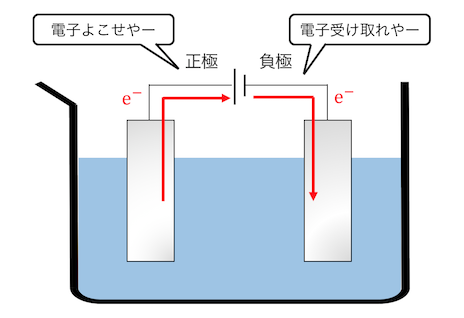
正極側は無理やり電子を投げさせられ、
負極側は無理やり電子を押し付けられています。
「電子を投げる=酸化反応」
「電子を受け取る=還元反応」でしたね。
このように電池によって無理やり酸化還元反応が起こされているのです。
酸化還元反応の仕組みを酸化数から理解しよう!
電気分解の仕組み
電池によって無理やり酸化還元反応が起こされるのが、
電気分解の基本原理でした。
そうしたら当然、
正極側にいる誰かが電子を投げる(=還元剤になる)、
負極側にいる誰かが電子を受けとる(=酸化剤になる)必要があります。
還元剤・酸化剤になるのは、
そこにある物質の中で一番酸化されやすい/還元されやすいものです。
本当は反応を起こしたくないのに電池に強制されて、
誰かが反応しないといけないから、
結局その中で「まだマシ」なやつが反応するのです。
では実際にどのような酸化還元反応が起こるのかを、
順番に見ていきましょう。
説明に入る前に言葉の定義をします。
電気分解を行う時の電極のうち、
電池の正極につながっている方を「陽極」、
電池の負極につながっている方を「陰極」と呼びます。
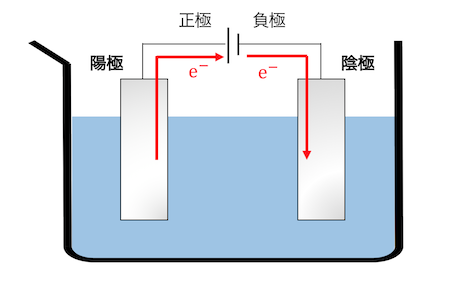
それでは陽極と陰極の反応を順番に見ていきましょう。
陽極での酸化反応
陽極は「正極につながった電極」なので、
正極に電子を投げる必要があります。
電子を投げる役割は以下の順で決まります。
①金属の電極が電子を投げる
②金属が無理なら溶液中の陰イオンが投げる
③それも無理なら水が投げる
では詳しく見ていきましょう。
①金属の電極が電子を投げる
金属は本来陽イオンになりやすいですから、
まずは金属が還元剤の役目を買います。
(例2)Ag→Ag++e–
これによって電極が溶け出します。
しかしAuやPtなどのイオン化傾向が極端に低い金属や、
Cなどの非金属が電極になっていた場合は反応できません。
その場合は他のやつにバトンタッチです。
②金属が無理なら溶液中の陰イオンが投げる
電極がAu、Pt、Cなどで反応できない場合は、
溶液中の陰イオンが反応します。
陰イオンは原子の状態より電子を多く持っているので、
金属が溶け出すことの次に反応しやすいのです。
(例2)4OH–→O2+2H2O+4e–
(※例2は強塩基性でOH–が十分あるとき)
ただし陰イオンであったとしても
NO3–やSO42-などは、
NとSの酸化数が最大だからこれ以上酸化されません。
このように電極の金属も陰イオンも反応できない場合、
最後の手段に出ることになります。
酸化数の求め方!定義から丁寧に
③それも無理なら水が投げる
金属の電極も陰イオンもダメだったとき、
だからと言って「じゃあ反応しません」とは言えません。
電池に無理やり反応を起こされていますからね。
金属も陰イオンもダメなとき、
最後の手段として水が反応します。
このようにして、
どんなに追い詰められても電子を投げざるを得ず、
最後には水が反応してまで電子を投げるのです。
陽極の反応まとめ
結局のところ陽極では、
①Au、Pt、C以外の電極が反応
②NO3–、SO42-以外の陰イオンが反応
③最終手段として水が反応
という酸化反応が起こっているということになります。
陰極での還元反応
陰極は「負極につながった電極」なので、
負極から電子を受け取る必要があります。
誰が電子を受け取るかについては、
以下のように決まります。
①溶液中の陽イオンが受け取る
②無理そうなら水が受け取る
では詳しく見ていきましょう。
①溶液中の陽イオンが受け取る
陽極の時とは違って、
一般的に金属でできている電極が電子を受け取るのは無理そうです。
そこで陽極で陰イオンが電子を投げたの同様、
陰極では陽イオンが電子を受け取ります。
(例2)Cu2++2e–→Cu
(例3)2H++2e–→H2
(※例3は強酸性でH+が十分あるとき)
ただし、
ここで少し注意が必要です。
陽イオンが電子を受け取るといっても、
イオン化傾向が十分大きいとなかなか電子を受け取ってくれません。
例えばNa+、K+、Al3+などがいても、
電子を受け取ってくれないんです。
その場合は最後の手段です。
②無理そうなら水が受け取る
陽極の時と同様、
「電子を受け取らない」という選択肢はありません。
よって最終手段として水が反応します。
陰極の反応まとめ
結局のところ陰極では、
①イオン化傾向が小さい陽イオンが反応
②イオン化傾向が大きいものばかりなら水が反応
という還元反応が起こっているということになります。
イオン化傾向が中くらいのZn、Fe、Niなどは電圧や濃度、電極の種類などによって反応が変化します。入試レベルでは問われることがないです。H、Cu、Agならイオン化傾向が小さい、K、Ca、Na、Mg、Alならイオン化傾向が大きい、と思ってしまって構いません。
電気分解の応用例
歴史的には、電気分解は、
金属元素の発見に大きく貢献しました。
物質の電気的な性質を明らかにするのに、
非常に役立ったのです。
そんな電気分解は現在でも利用されている例をいくつか紹介します。
イオン交換膜法
電気分解をストレートに利用した応用例に、
「イオン交換膜法」があります。
イオン交換膜法は電気分解に陽イオン交換膜を組み合わせた、
水酸化ナトリウムの工業的製法です。
詳しくは以下をチェック!
金属のメッキ
物質の表面に薄く金属をはりつけることを「メッキ」といいます。
これによって物質の強度を増したり、
イオン化傾向の低い金属のメッキでサビを防いだりします。
電気分解を行うと陰極には金属がはりつきますが、
これを利用してメッキしたい金属を陰極にすることで、
メッキをすることができます。

(株式会社「明光社」ホームページより)
また「ブリキ」は鉄にスズをメッキしたものです。イオン化傾向が小さいスズをメッキすることで錆びを防ぎますが、メッキが剥がれてしまうと錆びが中の方まで侵入してしまいます。
金属の電解精錬
陽極では電極が溶け出し、
陰極では金属だけが張り付くことを利用して、
純度の高い金属を得るのにも電気分解が使われます。
このような手法を「電解精錬」といいます。
以下の記事では不純物の多い粗銅から純銅を得る、
「銅の電解精錬」について説明してるので、
参考にしてみてください。
融解塩電解
今回解説した電気分解は全て水溶液中でしたが、
水を排除し、塩を直接溶かしてしまって電気分解を行うのが「融解塩電解」です。
通常は最後の手段として水が反応しますが、
その水さえいなくなった場合は、
イオン化傾向が大きいNaやAlが反応してくれるのです。
融解塩電解は以下で詳しく説明しているので、
参考にしてみてください。
まとめ
今回は電気分解の解説をしました。
電気分解は電池によって無理やり起こしていて、
陽極では電子を投げることを、
陰極では電子を受け取るのを強制されているんでしたね。
これによって結果的に、
・陽極
①Au、Pt、C以外の電極が反応
②NO3–、SO42-以外の陰イオンが反応
③最終手段として水が反応
・陰極
①イオン化傾向が小さい陽イオンが反応
②イオン化傾向が大きいものばかりなら水が反応
という反応が起こされるのでした。
一見覚えることが多そうな電気分解も、
仕組みを理解すれば自然に思い出せるのではないでしょうか。














お世話になっております。初めてコメントさせていただきます。
娘の大学受験に触発されて30数年ぶりに化学を学び直しているところです。先生の解説はとてもわかりやすく、苦手だった化学が好きになってきました。ありがとうございます。
一点ご質問させていただきたいことがございます。
電気分解の陰極での反応についてですが、
まとめには、
1.イオン化傾向が大きい陽イオンが反応
2.イオン化傾向が小さいものばかりなら水が反応
と書かれていました。しかしながら、一方で、銀イオン、銅イオンといったイオン化傾向の低い陽イオンが反応するような事例、イオン化傾向が十分大きい陽イオンは電子をなかなか受け取ってくれない、といった記述もあり、どう考えればいいのか混乱しています。
ご教授いただければ幸いです。
コメントありがとございます、
苦手な化学が好きに、と言うのはとても嬉しいです!
さてご質問に関してですが、
申し訳ないですがまとめの文章を書き間違えていました。。。
正しくは、
1.イオン化傾向が小さい陽イオンが反応
2.イオン化傾向が大きいものばかりなら水が反応
です。
混乱を与えてしまってすいません。
一人で記事作成しているのでミスに気づきづらいです。。
ご確認よろしくお願いします。