緩衝液は一見難しく感じますよね。
ややこしそうな見た目の電離定数をやり、
加水分解という新しい現象を習い、
その後に出会うのが緩衝液。
緩衝液にたどり着く頃には、
頭の中がハテナだらけになっていることでしょう。
しかし実は、
緩衝液はその目的さえ分かっていれば、
実はめちゃくちゃ簡単に問題が解けてしまうのです。
今回は緩衝液をわかりやすく解説します。
この記事を読めば、
緩衝液の意味や計算の仕方はもう完璧になり、
「何も迷うところないじゃん!」と感じるようになります。
ぜひ最後まで飛ばさずに読んでみてください。
緩衝液とは
「緩衝液」とは、
pHの変化を和らげてくれる液体のことを指します。
具体例として以下の酢酸を考えてみましょう。
\mathrm{ CH_{3}COOH ⇆ CH_{3}COO^{-} + H^{+} }
\]
ここでルシャトリエの原理を思い出してみましょう。
H+を入れれば反応は左に進み、
pHが下がるのを和らげてくれます。
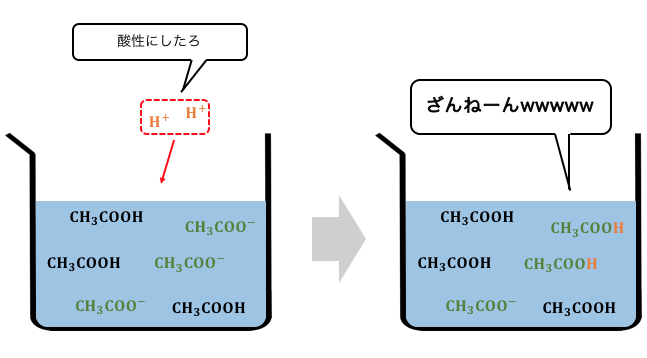
一方で、
OH–を入れれば中和反応を起こし、
平衡が右に進んでH+が補充されることで、
pHが上がるのを和らげてくれます。
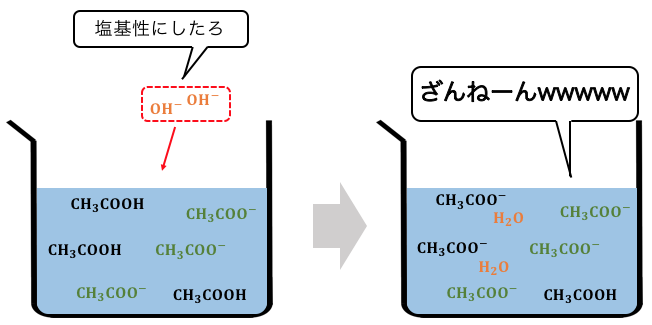
このような性質を持つのが緩衝液です。
緩衝液
先ほど考えたように、
酢酸の電離は緩衝液として働きました。
しかしただの酢酸が緩衝液になるわけではありません。
これは電離定数の計算を思い出すと理由がわかります。
電離度をαとしたときに、
α<<1より1-α≒1と近似して計算しましたよね。
このように酢酸の電離度はめちゃくちゃ小さいため、
CH3COO–が少なすぎるのです。
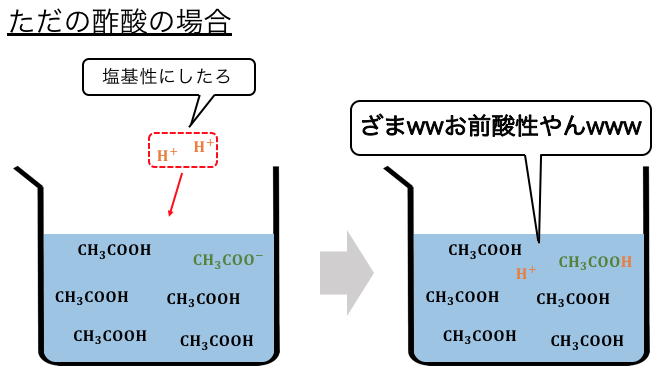
だから酢酸を緩衝液にするためには、
酢酸イオンを足す必要があります。
次の章で具体的な作り方を見てみましょう。
緩衝液の作り方
緩衝液を作るためには、
酢酸に対して、酢酸イオンを追加する必要があります。
そこで、
酢酸の塩である酢酸ナトリウムをいれます。
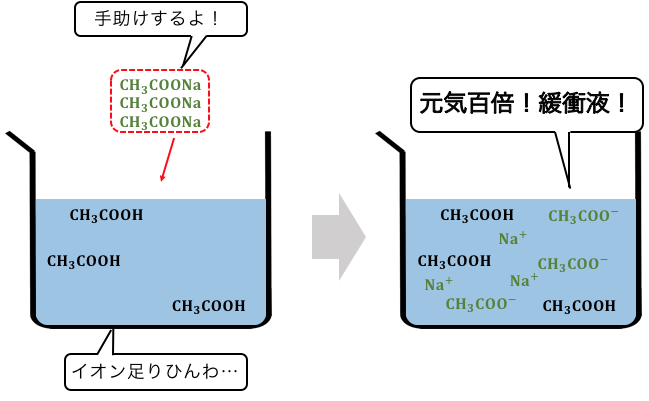
これで緩衝液ができました。
ちなみに酢酸と酢酸ナトリウムは、
だいたい同じくらいの量であれば緩衝作用を示します。
では次に、
緩衝液の[H+]を考えてみましょう。
緩衝液のpH計算
Ca[mol/L]の酢酸、Cs[mol/L]の酢酸ナトリウム
を混ぜて緩衝液を作ったしましょう。
まず酢酸は以下のように電離します。
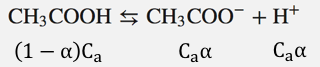
酢酸ナトリウムは100%電離するので、
以下のように酢酸イオンが増えます。
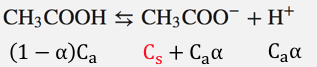
①そもそもCH3COOHがいっぱいある
②加水分解はごく少量しか起こらない
という理由で無視できます。
さて、ここで電離度αに注目です。
電離度αは1よりもかなり小さいので、
1-α≒1と近似してよかったですね。
もっと言えば、
今回は酢酸イオンを大量に加えているので、
ルシャトリエの原理から平衡が左に進み、
αはより小さくなっていると考えられます。
だから結局、
\begin{align*}
\mathrm{ [CH_{3}COOH] } &= \mathrm{ C_{a}(1-α) ≒C_{a}}\\
\mathrm{ [CH_{3}COO^{-}] } &= \mathrm{ C_{s}+αC_{a} ≒C_{s}}
\end{align*}
のようになります。
よって電離定数の定義を思い出せば、
\begin{align*}
\mathrm{ K_{a} } &= \mathrm{ \frac{[CH_{3}COO^{-}][H^{+}]}{[CH_{3}COOH]} }\\
\mathrm{ K_{a} } &= \mathrm{ \frac{C_{s}[H^{+}]}{C_{a}} } \\
\mathrm{ [H^{+}] } &= \mathrm{ \frac{C_{a}}{C_{s}}K_{a} }
\end{align*}
このようにして緩衝液の[H+]がわかりました。
それでは実際の問題を使って、
緩衝液の性質を確認していきましょう。
練習問題
それでは緩衝液の性質を見てみましょう。
具体的に自分で計算してみると、
その性質に感動できると思います。
ぜひ最後までついてきてください。
①緩衝液の調製
それではまずは緩衝溶液を作ってみましょう。
緩衝溶液の計算では、
濃度計算で少しトリッキーなところがあります。
注意しながらみていきましょう。
先ほども説明した通り、
\[\mathrm{CH_{3}COOH⇆CH_{3}COO^{-}+H^{+}}
\]の平衡が起こっていて、
酢酸のほとんどは最初に用意した酢酸の分、
酢酸イオンのほとんどが酢酸ナトリウムの分でした。
しかしこのとき、
2つの溶液を混ぜることで、
濃度が薄まっていることに気をつけましょう。
\begin{align*}
\mathrm{[CH_{3}COOH]} &= \mathrm{0.50×\frac{100}{200}} \\
\mathrm{[CH_{3}COO^{-}]} &= \mathrm{0.70×\frac{100}{200}}
\end{align*}
よって以下のとおり。
\begin{align*}
\mathrm{ [H^{+}] } &= \mathrm{\frac{0.50×\frac{100}{200}}{0.70×\frac{100}{200}}×2.8×10^{-5}} \\
&= \mathrm{2.0×10^{-5}} \\
\mathrm{pH} &= \mathrm{-log_{10}(2.0×10^{-5})}=4.7
\end{align*}
\begin{align*}
\mathrm{[H^{+}]} &= \mathrm{\frac{C_{a}}{C_{s}}K_{a} } \\
&= \mathrm{ \frac{n_{a}/V}{n_{s}/V}K_{a} } \\
&= \mathrm{ \frac{n_{a}}{n_{s}}K_{a} }
\end{align*}
②緩衝作用の確認
それではついに、
緩衝液の性質を見ていきます。
緩衝液の性質を体感してみましょう。
まず緩衝液中の酢酸、酢酸ナトリウムは、
\begin{align*}
\mathrm{ CH_{3}COOH } &: \mathrm{ 0.050×\frac{100}{200}=0.025mol } \\
\mathrm{ CH_{3}COONa } &: \mathrm{ 0.070×\frac{100}{200}=0.035mol }
\end{align*}そして加えた塩酸は、
\[\mathrm{n_{HCl}=0.10×\frac{30}{1000}=0.003mol}
\]さてここで先ほどの平衡を思い出しましょう。
\[\mathrm{CH_{3}COOH⇆CH_{3}COO^{-}+H^{+}}
\]H+が増えればそれを打ち消すために、
左に反応が進みます。
つまりCH3COOHがHCl分増え、
CH3COONaがHCl分減るのです。
\begin{align*}
\mathrm{ n_{a} } &= \mathrm{ 0.025+0.003 = 0.028} \\
\mathrm{ n_{s} } &= \mathrm{ 0.035-0.003 = 0.032}
\end{align*}
よって「ポイント」の公式を使えば、
\begin{align*}
\mathrm{[H^{+}]} &= \mathrm{ \frac{n_{a}}{n_{s}}K_{a} } \\
&= \mathrm{ \frac{0.028}{0.033}K_{a} } \\
&≒ \mathrm{ 2.5×10^{-5} } \\
\mathrm{ pH } &= \mathrm{ -log_{10}(2.5×10^{-5}) } = \mathrm{ 4.6 }
\end{align*}
なんと塩酸を入れたのにpHが4.7から4.6に変わっただけです。
これが緩衝液の面白いところです。
塩基性になった場合もほぼ同じ考え方なので、
ぜひ問題を探して解いてみてください。
参考:実は身近な緩衝液
実は身近なところに緩衝液があります。
それは人間の「血液」です。
より正確には血液中の血漿が緩衝作用作用を持っているんです。
ちょっと二酸化炭素が増えたりしただけで、
体内のpHが大きく変化したら困りますからね。
血漿の緩衝作用を司っているのが「炭酸」や「リン酸」。
以下の平衡で緩衝作用を示しています。
\mathrm{ HCO{3}^{-} } &⇆ \mathrm{ CO_{3}^{2-} + H^{+} } \\
\mathrm{ H_{2}PO{3}^{-} } &⇆ \mathrm{ HPO_{3}^{2-} + H^{+} }
\end{align*}
これによって体内のpHは7.35〜7.45という、
狭い範囲に収められています。
生物というのはよくできていますね。
ちなみに血液のpHが7以下になると昏睡状態に、
7.7以上になると失神を起こして、
いずれも心臓が停止してしまいます。
生物が生きていくのに緩衝液は欠かせません。
まとめ
今回は緩衝液の解説でした。
弱酸・弱塩基の平衡反応を利用して、
pHを調節するのが緩衝液でした。
しかしただ弱酸・弱塩基を用意しただけでは、
弱酸・弱塩基イオンが足りないために、
塩を同程度混ぜるのでしたね。
具体的な計算も必ず一度は経験しておいてください。













コメントを書く