今回は電子殻と電子配置の解説です。
電子配置はそれ自体が入試で問われることは少ないです。
しかし電子配置は、
少しハイレベルなところまで覚えておくことをおすすめします。
なぜなら、少し電子配置で苦労しておくことで、
その後の無機・有機化学の不思議な反応を説明でき、
「丸暗記地獄」から抜け出せるからです。
そこでこの記事では、
電子配置について少し踏み込んで解説します。
ここで説明する内容を理解することで、
今まで丸暗記だと思っていた無機化学と有機化学が、
「理解」できるようになるでしょう。
ただし多少大学レベルに踏み込むため、
一度読んだだけではなかなか受け入れづらいかもしれません。
何度も繰り返し復習して身につけましょう。
必ずその価値はあります。
目次
電子殻と軌道
まずは「電子殻」と「軌道」の説明です。
「軌道なんて聞いたことない!」
と言う人もいるかもしれませんが、
わかりやすく説明していくので安心してください。
それでは順番に見ていきましょう。
電子殻とは
その昔、
原子は陽子や電子からできているのはわかったものの、
具体的にどんな形になっているかわかりませんでした。
そんな中、「ボーア」が以下のような構造を提案します。
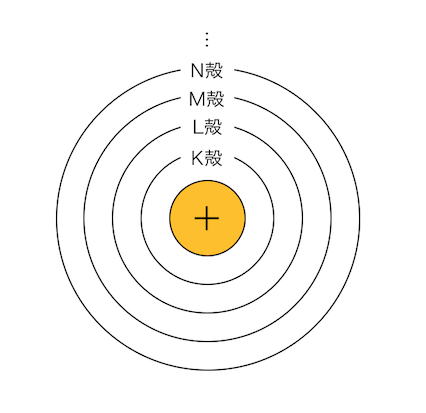
原子中で電子は「電子殻」の上を運動するとし、
電子殻を内側からK殻、L殻、M殻、N殻、…と呼ぶことにしました。
そしてこの電子殻には、
K殻には2個、L殻には8個、M殻には18個、…
の電子が収容されると考えたのです。
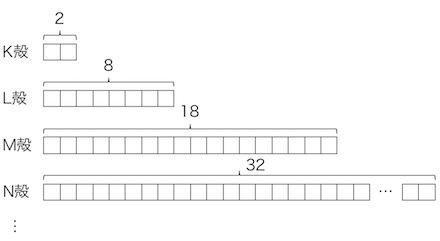
このように電子殻が定義されました。
軌道とは
電子殻が定義された後も研究が進み、
同じ電子殻の中の電子にも種類があることがわかりました。
その種類というのが「軌道」。
今までK、L、M、…という電子殻で考えていたけど、
実はもっと細かく分類できたのです。
軌道の分け方は以下の通り。
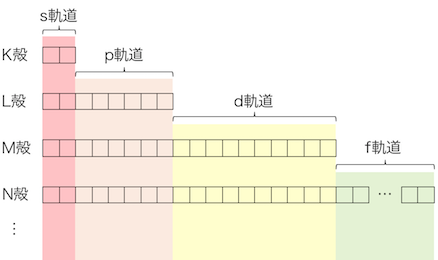
軌道はエネルギーの低い順に、
s軌道、p軌道、d軌道、f軌道、(以下g軌道からアルファベット順)と続きます。
とても難しそうに感じるかもしれませんが、
ただ新しい名前が出てきただけです。
「K殻っていうのがあるんだよー」
と初めて教えられたときと同じです。
それでは話を続けましょう。
例えばs軌道は全ての電子殻に存在し、
p軌道はK殻以外の全ての電子殻に存在します。
これらの軌道は以下のように数字をつけて区別します。
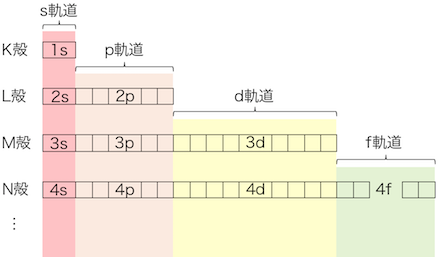
K殻から順に1、2、3、…と番号をつけ、
それぞれの軌道の前につけて「1s軌道」や「2p軌道」と呼びます。
さて、ここまでで軌道とはなにかと、
軌道の名前を説明しました。
では次にそれぞれの軌道に電子がいくつ入るかを見てみましょう。
各軌道の収容電子数
s軌道、p軌道、d軌道、…にはそれぞれ、
1個、3個、5個、…と「奇数個」の軌道があります。
そしてそれぞれの軌道に2つずつ電子が詰まっていきます。
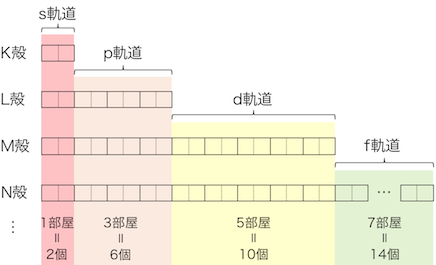
このように結果として、
順に2個、6個、10個、…の電子が詰まっていくことになります。
実は電子には「アップスピン」と「ダウンスピン」という2つの種類があります。1つの部屋にはアップスピンとダウンスピンが1つずつしか入れないのです。
電子配置の決まり方
それでは実際に電子配置を見ていきましょう。
おそらく今までは、
「エネルギーの低いK殻から順に詰まる」
と覚えてきたと思います。
しかし軌道を理解した今、
「エネルギーの低い軌道から順に詰まる」
となりそうだと想像できますね。
それでは軌道のエネルギーの順を確認し、
電子の詰まり方を見ていきます。
電子の収容順
先ほどまでの図を少し簡略化します。
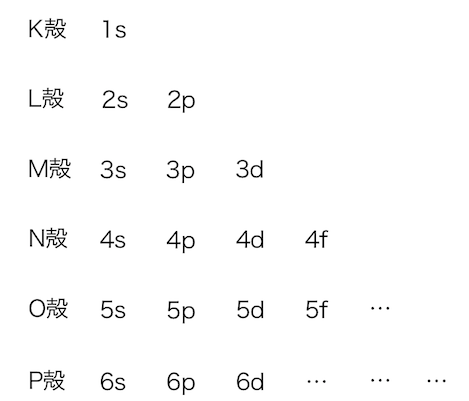
それぞれの軌道のエネルギー、
つまりは電子の詰まっていく順番は以下のとおりです。
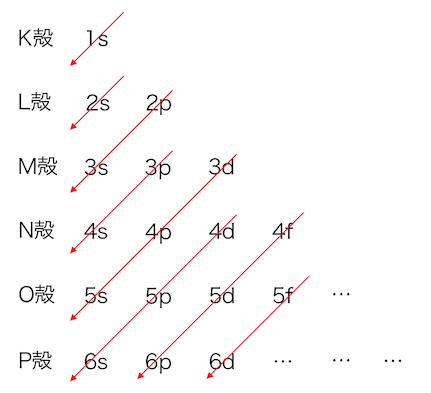
1s→2s→2p→3s→3p→4s→3d→…
という順で詰まっていきます。
このように見ると、
M殻の3d軌道の前にN殻の4s軌道が詰まるなど、
「K殻から順に」のルールが崩れています。
実はこれこそが「遷移元素」が存在する理由です。
それでは具体例を見ながら確認してみましょう。
例1:炭素原子
炭素の原子番号は6だから、電子を6つ持っています。
まずは最もエネルギーの低い1s軌道に電子が2つ入ります。
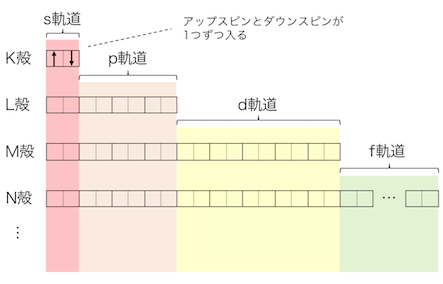
今回は電子を矢印で書いていますが、
これは先ほど簡単に説明した「スピン」を意識したものです。
↑であろうが↓であろうが、
矢印1つが電子だと思ってください。
1s軌道に電子が詰まったら次に2s→2pの順に詰まっていきます。
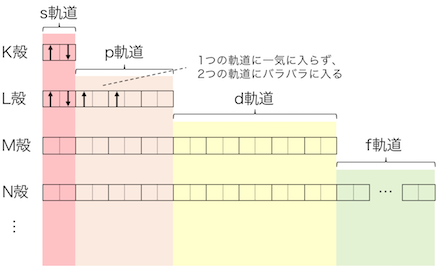
こうして6つ全ての電子が詰まりました。
電子殻で見るとK殻に2つ、L殻に4つで、
おなじみの電子配置になりました。
また、軌道で見た場合には、
6C:1s22s22p2
と軌道ごとに書いたりします。
例2:カルシウム原子
カルシウムは原子番号20だから、電子は20個詰まります。
最初の方は炭素と同じなので、
1s→2s→2p→3s→3pまで埋めてしまいましょう。
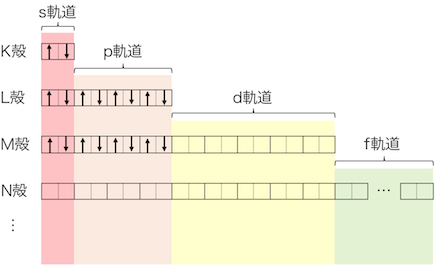
これで残り2個です。
電子殻的にはまだM殻が残っていますが、
軌道のエネルギーの順としては次は4sになりますね。
よって3d軌道をほったらかして、
4s軌道に入っていきます。
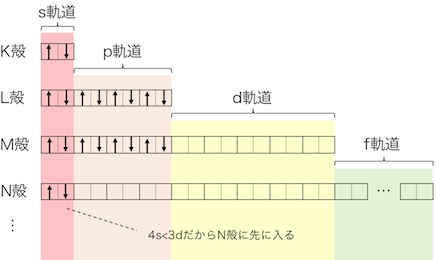
こうしてカルシウムの電子配置は、
20Ca:1s22s22p63s23p64s2
となります。
例)20Ca:[Ar]4s2
例3:スカンジウム原子
最後に原子番号21、電子数21のスカンジウムを見ていきます。
先ほどのカルシウムは電子数20でしたから、
電子1個を残して全てカルシウムと同じように詰まります。
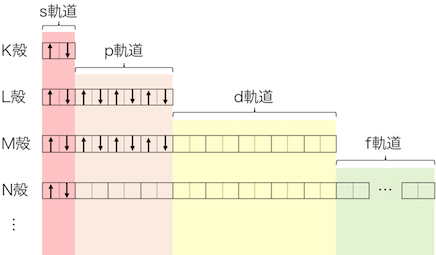
そして最後の1個は、
4s軌道の次にエネルギーの低い3d軌道に詰まります。
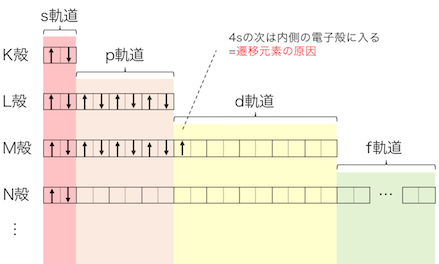
このようにして、
21Sc:1s22s22p63s23p64s23d1
もしくは、
21Sc:[Ar]4s23d1
と詰まっていきます。
この先最外殻電子は4s軌道の2個のまま、
3d軌道に入っていくことになり、
これが「遷移元素」が生じる原因です。
今までの疑問も少し晴れたのではないでしょうか。
応用:軌道の形
いままで軌道という言葉は、
「電子殻と同じで電子が入る場所のこと」
と説明してきました。
しかし実際には「軌道」と言う名前からわかるように、
軌道にも形があるのです。
例えばs軌道はこんな形。
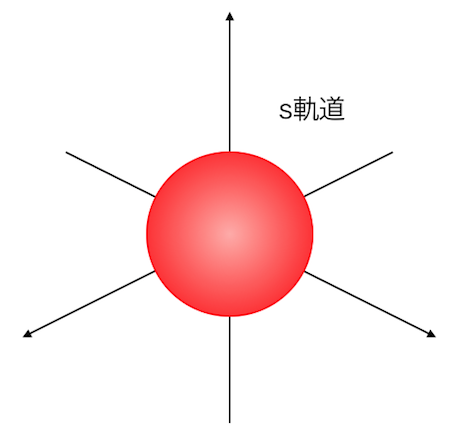
電子殻を想像させる形ですね。
実際、水素分子はこのs軌道どうしの共有結合でできています。
次にp軌道はこんな形になっています。
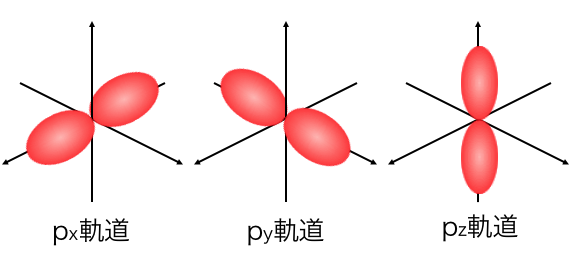
p軌道は3つあって、それぞれ異なる形です。
3つそれぞれがx軸、y軸、z軸方向に、
両手を伸ばしているような軌道になっています。
つまりp軌道を3つ合わせると、
3方向、6つの向きに手を伸ばしているということになります。
化学を一通り学んだことがある人なら、
これを見て「錯イオン」や「有機化学」を思い浮かべるのではないでしょうか。
ここでは詳しい説明はしませんが、
軌道を学ぶことでその先の化学がどんどん楽しくなっていくんです。
まとめ

お疲れさまでした。
初めての「軌道」はどうだったでしょうか。
最初はなんとなく難しく感じますが、
慣れてしまえば電子殻と大して変わらないと思えるはずです。
最後に電子配置を簡単に復習しておくと、
・エネルギーの低い軌道から順に詰まる
・1つの軌道には異なるスピンが入る
・同じ軌道はできるだけバラバラに入る
ということでした。
ぜひ何度も繰り返し復習してみてください。













コメントを書く