「ベンゼンの反応多すぎ…」
「よくわからん反応ばっかり!」
「とにかくベンゼン関係は丸暗記しないと!」
あなたは芳香族化合物の分野で、
こんな風に感じたことはありませんか?
たしかにベンゼンにはいろんな反応があり、
覚えるのは大変でしょう。
ベンゼンの反応を覚えるのが難しく感じるのは、
ベンゼン自体がどんな性質なのかを知らず、
反応の仕組みが理解できていないからです。
ここではベンゼンの性質、反応を解説します。
ここの内容を理解すると、
ベンゼン関係の反応が一気に理解でき、
全く苦労することなく覚えることができるでしょう。
高校の有機化学はそのほとんどが芳香族ですから、
ベンゼンを理解するだけで視界が晴れた気持ちになると思います。
ぜひ最後まだで読んでみてください。
目次
ベンゼンとは
「ベンゼン」とは、
C6H6で表される以下のような化合物です。
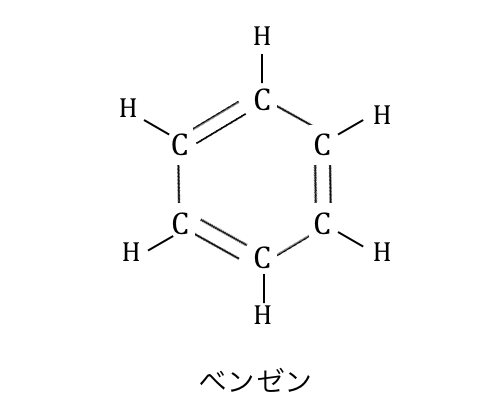
今までの有機化合物と比べても、
かなり特徴的な形ですよね。
この変な構造があることで、
ベンゼンは様々な反応を起こすことができるのです。
またそれは裏を返せば、
ベンゼンの性質をよく理解しないと、
有機化学が丸暗記になってしまうということ。
ぜひ読み飛ばさずに読んでみてください。
ベンゼンの構造
ベンゼンはその昔、油の熱分解から得られ、
分子式がC6H6であることだけがわかっていました。
様々な構造式が提案されるなか、
化学者「ケクレ」によって正六角形の構造が提案されたのです。
まずはケクレの構造式から確認します。
従来の考え方:ケクレ構造式
ケクレは以下のように、
単結合と二重結合が交互に現れる形を提案しました。
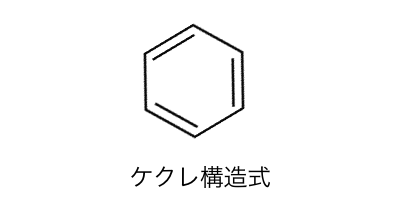
これによってベンゼンの性質をうまく説明できたのです。
しかし少し研究が進むと、
ケクレの構造式にも矛盾点が出てきます。
以下を見てみましょう。
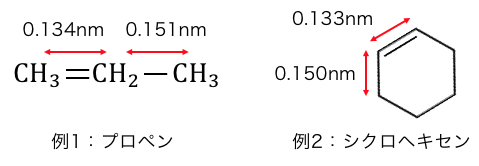
普通このように、
単結合の結合距離よりも二重結合の結合距離の方が短いはずです。
しかしベンゼンはなんと全て同じ長さだったのです。
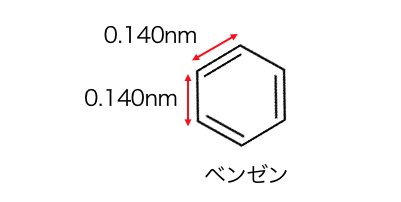
しかもベンゼンの結合は、
単結合と二重結合の間の長さになっています。
これを受けてさらに研究が進められていきます。
現在の考え方:ロビンソン構造式
実際のベンゼンの構造を考えるためには、
「分子軌道」を理解している必要があります。
まだ理解できていない人は以下をチェック!
ケクレ構造式では単結合と二重結合が交互にあるので、
分子軌道も考えれば以下のような構造になっています。
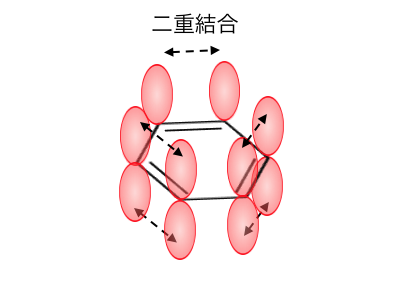
しかしこのように見てみると、
わざわざπ結合が交互にくる必要はないですね。
全てのp軌道が左右のp軌道と結合しても良さそうです。
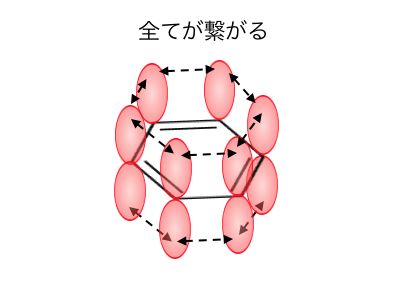
その結果最終的には、
p軌道が全て繋がって「電子の雲」のような状態になります。
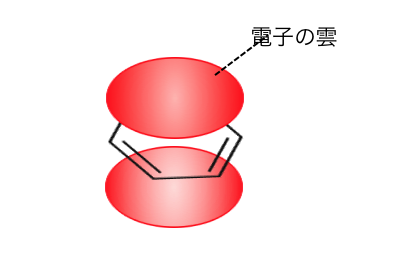
6つの炭素原子が全員で電子を持っている、
というような構造になっているのです。
よってベンゼンの構造式は、
以下のような「ロビンソン構造式」で書かれることがあります。
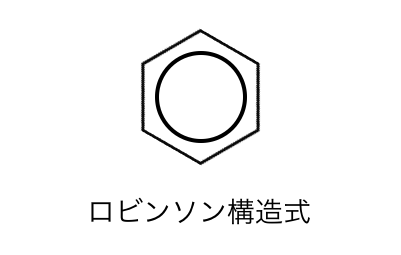
実はこの書き方の方が本質的だということですね。
そしてこの電子の雲の存在が、
ベンゼンの様々な反応に関わってくるのです。
記入例があれば従い、なければ好きな方でいいでしょう。ときどき「高校の教科書にないから減点」のような議論がありますが、大学がそんな本質的でないところで減点するとは思えません(そんな大学には行かなくていいでしょう)。あくまで書き方の問題なのであまり気にしないでください。
エネルギーで見るベンゼンの構造
ロビンソン構造式の方が本質的であることを、
エネルギー的にも確認しておきましょう。
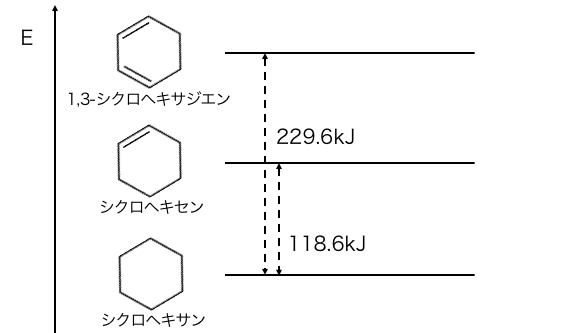
このように、
シクロヘキセンに水素を付加した時の熱は約120kJ、
1,3-シクロヘキサジエンに水素を付加した時の熱は約230kJです。
つまりベンゼンがケクレ構造式であるなら、
ベンゼンに水素を付加すると350~360kJ程度になると予想できます。
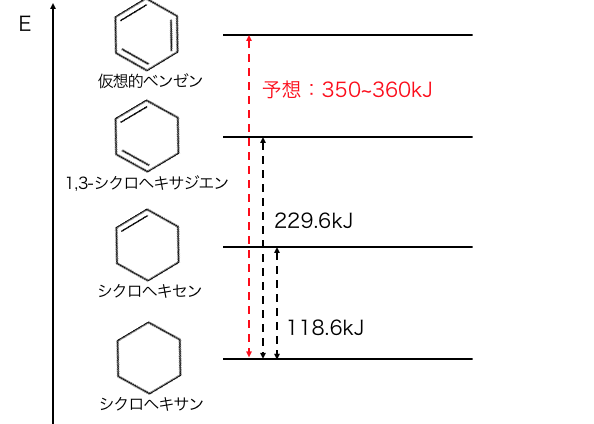
しかし、
実際にベンゼンに水素を付加すると、
約210kJしか熱を発しません。
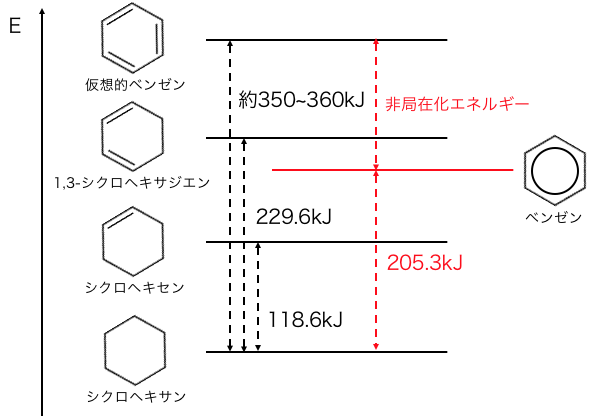
やはりベンゼンは、
π結合が非局在化することによって、
より安定な構造になっているということになります。
ベンゼンの反応
それではベンゼンの反応を見ていきましょう。
ベンゼンの反応の基本は、
ベンゼンの電子の雲を狙う陽イオンによる攻撃です。
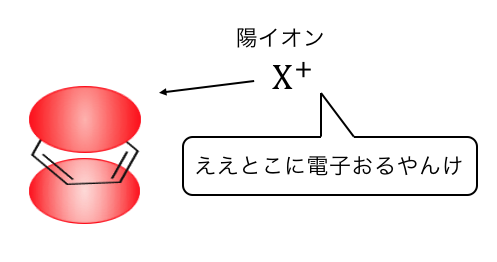
これによって「置換反応」が起こるのです。
実際の反応をいくつか見てみましょう。
置換反応
陽イオンによる攻撃で起こる置換反応には、
①ニトロ化
②スルホン化
③ハロゲン化
④アルキル化
があります。
なぜ陽イオンが現れて、
どのように反応するのでしょう。
反応のストーリーを見ながら覚えると、
ただ丸暗記するよりも納得感もあるし定着も早いです。
仕組みを丸々覚える必要は全くないので、
「そうなんだー」という気持ちで読んでみてください。
①ニトロ化
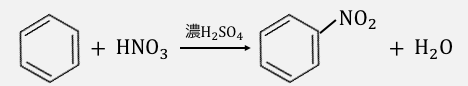
濃硫酸は水素イオンを押し付ける能力がめちゃくちゃ高いです。
よって硝酸に濃硫酸を混ぜると、
以下のように硝酸の-OHに無理やり水素を押し付け、
「ニトロニウムイオン」と水を作ります。
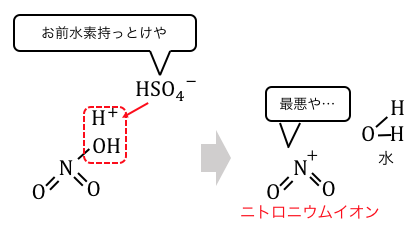
これは当然不安定ですから、
電子の雲を持ったベンゼンに攻撃を仕掛けます。
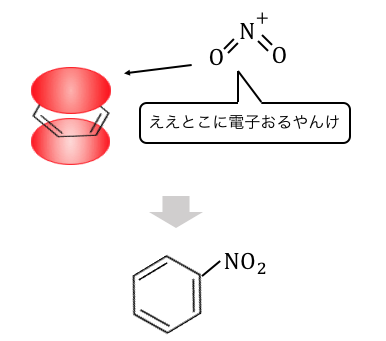
これによって「ニトロベンゼン」が作られるのですね。
②スルホン化
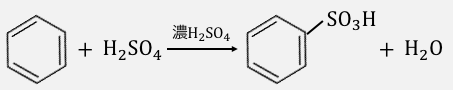
スルホン化もニトロ化と同じ仕組みです。
硫酸分子に濃硫酸が水素を押し付けて陽イオン化し、
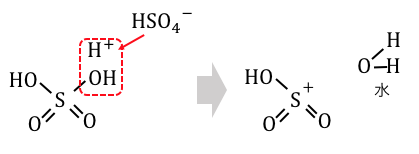
電子の雲に攻撃を仕掛けます。
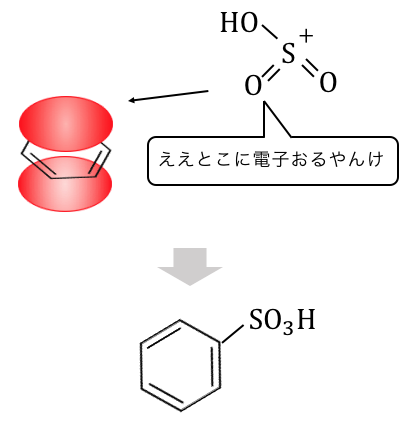
自分自身が触媒となって、
反応が進んでいるのですね。
③ハロゲン化
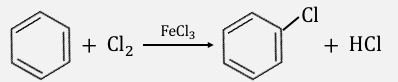
ハロゲン化は特殊な触媒によって起こされます。
少しトリッキーなので、
注意して見ていきましょう。
ハロゲン化には「ハロゲン化鉄(Ⅲ)」を触媒として使います。
鉄イオンはハロゲンと錯イオンを作りやすいです。
例えば塩素に対しては[Fe(Cl)4]–を作りやすいのです。
よってハロゲン化鉄とハロゲンを一緒に置くと、
以下のように錯イオンを作りたがります。
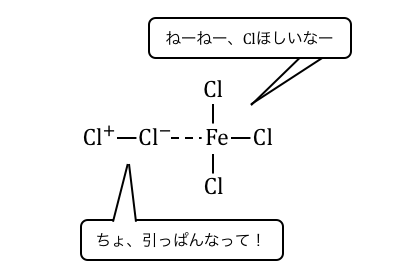
これによってハロゲンの片方が、
陽イオンのような状態になってしまうのです。
そんなところに電子の雲を持ったベンゼンがいると、
陽イオンによる攻撃が発生します。
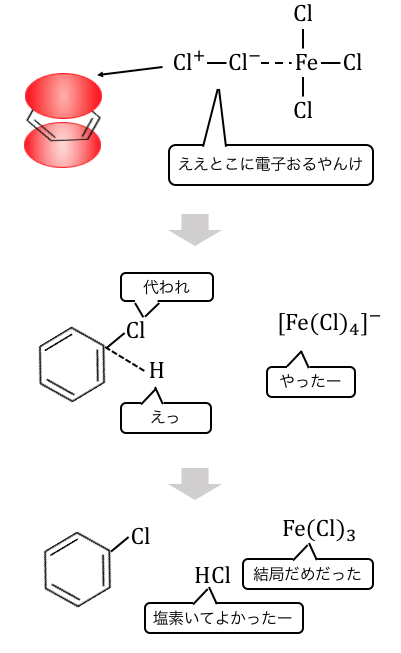
最後に生じた水素イオンがハロゲンを奪うので、
ハロゲン化鉄は反応の前後で変化せず、触媒となります。
このように、
ハロゲン化には触媒が必要不可欠なのですね。
④アルキル化
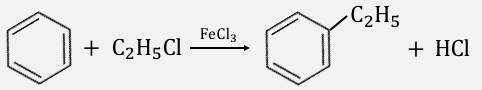
最後にアルキル化です。
アルキル化はハロゲン化にかなり近い仕組みで起こります。
塩化アルキルに対して塩化鉄(Ⅲ)を入れると、
際ほどと同じ原理で塩素を引き抜きます。
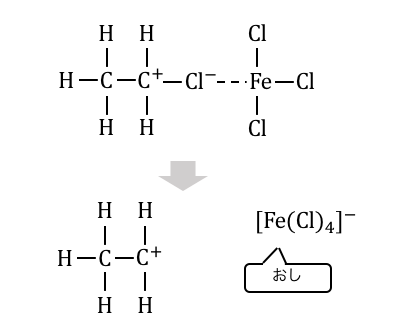
先ほどのハロゲンと違って、
アルキル基の方が電気陰性度が小さいため、
完全に引っこ抜いてしまうのです。
これによって生じた陽イオンが、
電子の雲に攻撃を仕掛けます。
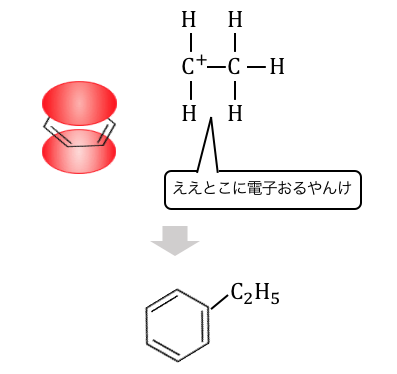
結局のところどの反応も陽イオンによる攻撃でしたね。
付加反応
このようにベンゼンへの反応の基本は、
陽イオンによる置換反応でした。
もし付加反応を起こそうとすると、
非局在化による安定を破壊することになるので、
相当頑張らないといけないことになります。
しかし「ラジカル反応」を起こせば、
以下のように付加反応を起こすことも可能です。
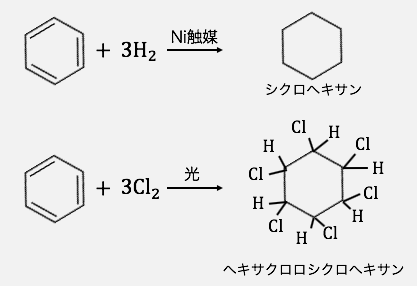
「ラジカル」とは、
光や触媒の力で分子の結合が切られ、
イオンではなく原子になってしまった状態のことです。
そんな不安定なラジカルが攻撃することで、
ベンゼンのπ結合を食い尽くしてしまうのです。
ラジカル反応はアルカンの反応で出てきました。
ぜひそちらも確認しておいてください。
参考:ベンゼンの構造異性体

最後にベンゼンの構造異性体を紹介します。
入試では絶対に問われない内容なので、
そういう内容に興味がなければここは読まなくても大丈夫です。
その昔ベンゼンは、鯨油の熱分解によって発見されます。
この時点では、
分子式がC6H6だということしかわかっていませんでした。
その構造がどうなっているかに対して、
いろんな案が提案されます。
例えば「デュワー」の構造式。
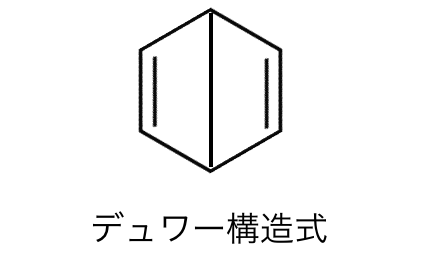
ぱっと見ではベンゼンに似ていますが、
実際の形としてはこのようになるでしょう。
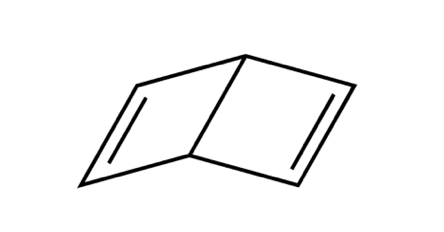
2つのエチレンを持ってきて炭素で繋げたような構造ですね。
これはその後実際に合成に成功し、
「デュワーベンゼン」と呼ばれています。
しかし普通sp3軌道の結合角は109.5°、
sp2軌道の結合角は120°ですが、
デュワーベンゼンの炭素原子の結合角は90°になっています。
この不安定さから、
デュワーベンゼンを放置すると徐々にベンゼンに変わってしまいます。
そのほかにラーデンブルクも以下のような構造を考えました。

これは「プリズマン」と呼ばれ、
結合角が60°であることからもわかるように、
デュワーベンゼンよりもはるかに不安定です。
炭化水素には珍しく爆発性もあります。
もはやベンゼンとは関係なくなってしまいますが、
C8H8の化合物でプリズマンに似ているのが以下の「キュバン」です。
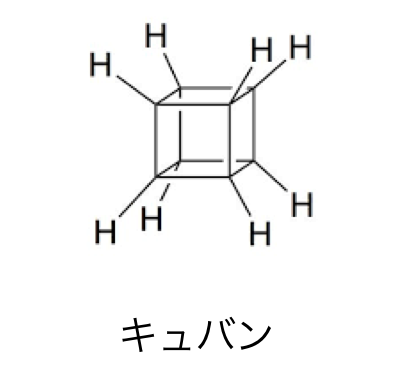
これも結合角から見てかなり不安定で、
合成は不可能だと考えられていましたが、
1964年にシカゴ大学のイートン教授によって合成されます。
面白いことに一度合成されてしまうと、
うまい分解のされ方がなく、
なんだかんだ安定に存在します。
イメージとしては立方体の中にエネルギーを蓄えている感じですね。
このキュバンの水素をニトロ基に置き換えたのが、
「オクタニトロキュバン」です。
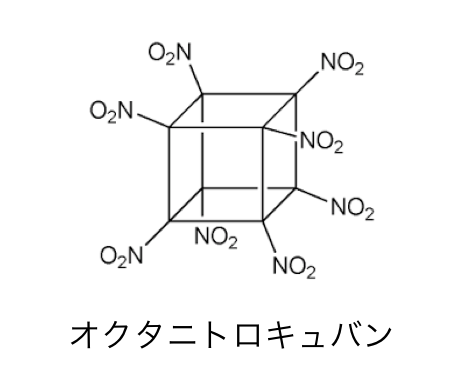
ニトロ系の化合物には爆発性があるのはご存じでしょう。
エネルギーを蓄えた状態のキュバンに、
ニトロ基が8つも付いたオクタニトロキュバンは、
理論上最強の爆薬と言われています。
(正直「理論上最強の爆薬」っていうための章です)
まあ話を戻すとケクレ構造式が発見されるまでには、
様々な苦労があったのですね。
ロビンソン構造式の方が本質的とは言いましたが、
ケクレ構造式がどれだけ奇抜な提案だったかがわかると思います。
まとめ
今回はベンゼンの解説でした。
ここまで読んでくれている人は、
オクタニトロキュバンで頭がいっぱいだと思うので、
ベンゼンの反応を簡単にまとめておきましょう。
ベンゼンは非局在化によって電子の雲を持っています。
この雲に陽イオンが飛びつくことで置換反応が起こり、
その置換反応には、
①ニトロ化
②スルホン化
③ハロゲン化
④アルキル化
などがあるのでした。
①②は濃硫酸によって、③④は塩化鉄触媒によって、
陽イオン化されていましたね。
このように通常は置換反応ですが、
ラジカル反応であれば無理やり付加反応を起こせます。
ハロゲンや水素のラジカル反応により、
全ての結合に付加反応を起こすのでした。
ここまで理解できればベンゼンの反応で迷うことはもうないでしょう。
さらにはフェノールなどの今後の物質も、
相当深く理解できると思います。














「ヘキサクロロシクロヘキサン」となっていますが、塩素が12個ついている図になっています。
あら、ほんとですね、なんで気づかなかったんだー 笑
直しておきます、ご指摘ありがとうございます!