今回はアルミニウムの工業的製法の解説です。
アルミニウムの製法は意外と手順が多く、
さらに「融解塩電解」という聞きなれない方法を利用するため、
しっかりと理解できている受験生は少ないです。
そのような浅い理解で暗記だけをしていても、
いつの間にか忘れていってしまいます。
この記事ではアルミニウムの製法について、
仕組みから丁寧に解説します。
ここで教える内容を身につけることで、
センター試験などで問われたとしても、
全く迷うことなく解答できるようになります。
それでは解説していきます。
目次
アルミニウムの製法の仕組み
アルミニウムは非常にイオン化傾向が高い元素です。
鉄は一酸化炭素による還元反応を用いて、
銅は電解精錬を用いて手にいれることができましたが、
アルミニウムは簡単にはいかないのです。
そこでアルミニウムの単体を手にいれるために、
「融解塩電解」を行う必要があります。
まずは以下の普通の電気分解を見てみましょう。
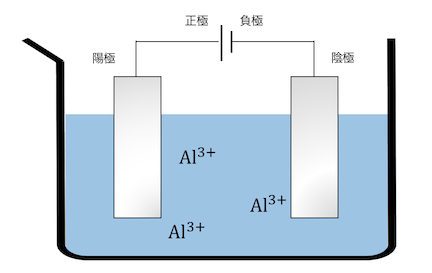
銅と同じように電気分解を行うとします。
しかしアルミニウムのイオン化傾向が高すぎて、
水素イオンの方が先に反応してしまいます。
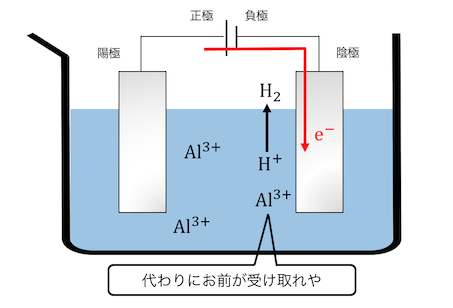
このように普通の電気分解では水が邪魔なのです。
そこで水を排除するために
溶かしたアルミニウム塩で電気分解をします。
このようなめちゃくちゃなことをしてようやく、
単体のアルミニウムが手に入ります。
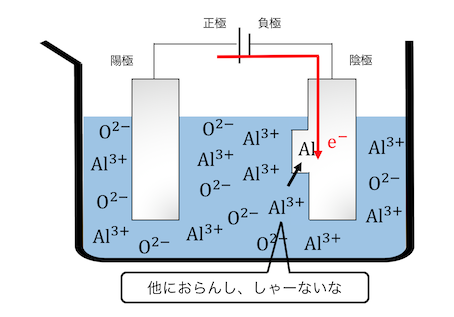
アルミニウムのようなイオン化傾向の高い元素は、
塩を直接溶かして電気分解する「融解塩電解」をして、
単体を取り出す必要があるのです。
それでは実際に、
融解塩電解が行われるまでの流れを見てみましょう。
2Al2O3+9C→Al4C3+6CO
Al4C3+Al2O3→6Al+3CO
しかし非常に高温(2200℃)にする必要があります。
アルミニウムの製法の流れ
アルミナAl2O3を融解塩電解したいですが、
そのためにはまずアルミナを手にいれる必要があります。
自然界から産出するアルミナを含む鉱石が、
「ボーキサイト」です。
ボーキサイトにはアルミナAl2O3の他に、
酸化鉄Fe2O3なども混ざっているため、
アルミナのみを取り出す必要があります。
以上を踏まえて、
アルミニウムを作る流れは以下の通りです。
①ボーキサイトをNaOHに溶かす
②溶液を薄めてAl(OH)3を沈殿させる
③加熱してアルミナ(Al2O3)を作る
④融解塩電解を行いAlを得る
順番に解説していきます。
①ボーキサイトをNaOHに溶かす
Al2O3とFe2O3が混ざったボーキサイトから、
アルミナだけを取り出すために、
アルミニウムが「両性元素」であることを利用します。
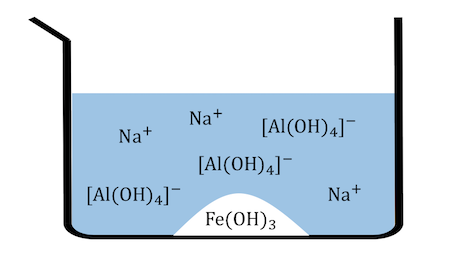
ボーキサイトを濃NaOH水溶液に溶かした場合、
アルミナAl2O3だけが溶け出し、
Fe2O3は沈殿として取り除けます。
Fe2O3+ 3H2O →2Fe(OH)3↓
②溶液を薄めてAl(OH)3を沈殿させる
①の溶液からFe(OH)3沈殿を取り除きます。
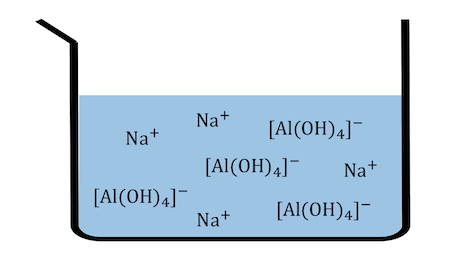
ここからアルミナを取り出したいです。
さて、ここで、
「少量のNaOHでAl(OH)3が沈殿する」
「過剰のNaOHで[Al(OH)4]–となって再溶解する」
というのを思い出しましょう。
これはどういうことかというと、
という平衡が成り立っているということです。
そこで、
大量の水で溶液を薄めることで、
平衡が左に進んでAl(OH)3沈殿を得ます。
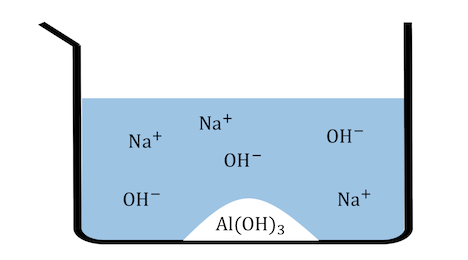
③加熱してアルミナ(Al2O3)を作る
手に入れたAl(OH)3を強く加熱し、
熱分解反応を起こしてアルミナを得ます。
④融解塩電解を行いAlを得る
アルミナを手にいれることができたので、
融解塩電解を行なっていきましょう。
アルミナを溶かして電気分解をしたいのですが、
ここで少し工夫をします。
アルミナは融点が約2000℃と非常に高いですが、
溶けた「氷晶石Na3AlF6」に溶かすことで、
融点を約1000℃まで下げることができます。
アルミナが溶けるとき、O2-が両手で2つのAl3+を引っ張り、全体は網目構造になります。このO2-の一部が氷晶石のF–に置き換えられることで不完全な網目構造になり、溶け出しやすくなります。
溶かしたアルミナを電気分解していきましょう。
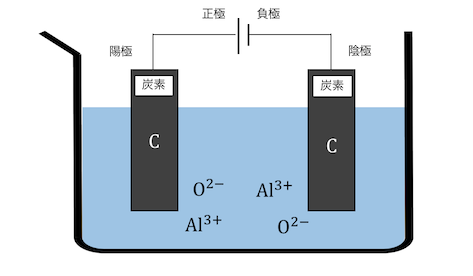
電極には炭素を用います。
電圧をかけると陽極で炭素が電子を投げ、
O2-と結びついてCOやCO2ができます。
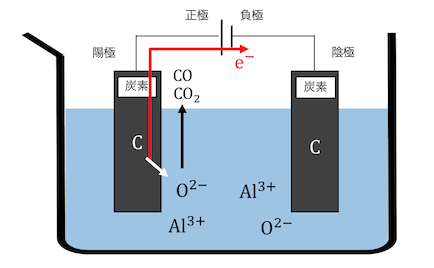
陰極ではアルミニウムが電子を受け取り、
単体のアルミニウムが付着します。
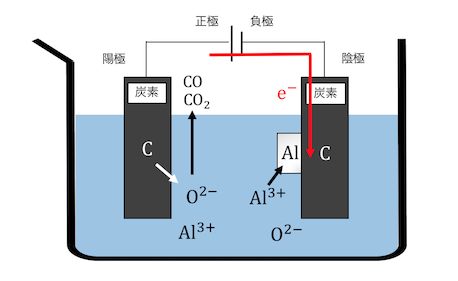
以上の反応をまとめれば、
こうしてアルミニウムの単体が手に入りました。
電気分解に暗記は必要ない!〜仕組みから理解しよう〜
参考:アルミ精錬と電力
アルミニウムは3価の陽イオンになりやすいため、
アルミニウムを電気分解するためには1原子あたり3個の電子が必要です。
さらにアルミニウムの原子量は27。
以上からアルミニウム1トンを作るのには、
13000kWhほどの電力が必要になります。
これは銅を1トン作るときの約11倍もの電力です。
このように生産に大量の電力が必要なことから、
アルミニウムは「電気の缶詰」と呼ばれることがあります。
アルミ缶、1円玉、アルミ箔などなど、
普段頻繁に目にするアルミを作るのに、
そんなに電力が使われているのですね。
しかしアルミニウムは、
「リサイクルの優等生」でもあります。
アルミ缶のリサイクル率は約95%にも登ります。
リサイクルをすることによって、
融解塩電解で使用する電力の約3%の電力で、
アルミを手にいれることができます。
アルミのリサイクルが節電になるんですね。
あなたもアルミ缶の飲み物を飲んだ時は、
しっかりアルミ缶のゴミ箱に捨てるようにしましょう。
まとめ
アルミニウムの工業的製法の解説でした。
原料のボーキサイトがアルミになるまでの流れは、
①ボーキサイトをNaOHに溶かす
②溶液を薄めてAl(OH)3を沈殿させる
③加熱してアルミナ(Al2O3)を作る
④融解塩電解を行いAlを得る
でしたね。
融解塩電解では、
融点の高いアルミナを溶かすのに氷晶石を使うのでした。
きっちり理解していないとすぐに忘れてしまうので、
不安なところはもう一度確認しておきましょう。













http://www.jukenmemo.com/chemistry/inorganic/molten-salt/
↑の記事で
以下の反応式はまちがっていませんか?
鉄の製法のように炭素によって還元していくことも可能です。
2Al2O3+9C→Al4O3+6CO
Al4O3+Al2O3→6Al+3CO
しかし非常に高温(2200℃)にする必要があります。
すいません、間違えてますね。正しくは、
2Al2O3+9C→Al4C3+6CO
Al4C3+Al2O3→6Al+3CO
でした…。
ご指摘ありがとうございます!