今回は水酸化ナトリウムの工業的製法である、
イオン交換膜法について解説します。
イオン交換膜法はあまり目にすることがないため、
たまに見つけると「なんだっけ?」となりがちです。
しかし実は原理自体はとっても簡単。
この機会にイオン交換膜法は完璧にしてしまって、
センター試験などでも確実に得点できるようにしましょう。
それでは解説していきます。
イオン交換膜法とは
「イオン交換膜法」とは、
電気分解によって水酸化ナトリウムを作る方法のことです。
何か特別な方法のように思ってしまいますが、
仕組みはただの電気分解なのです。
電気分解がまだ不安な人は、
以下もチェックして見てください。
仕組み自体は電気分解と同じですが、
「陽イオン交換膜」という特殊なものを使います。
陽イオン交換膜はその名の通り、
陽イオンだけを通して陰イオンを跳ね返す膜です。
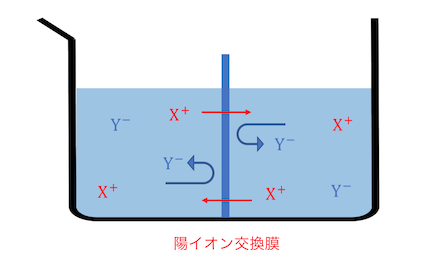
これ陽イオン交換膜をどのように利用するのか、
順番にみていきましょう。
イオン交換膜法の仕組み
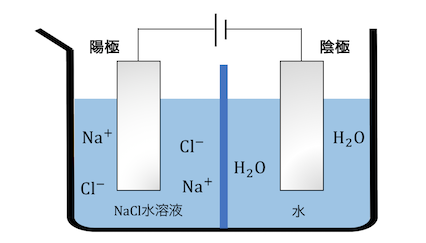
陽極側に濃NaCl水溶液、陰極側に水を入れて、
電気分解を行います。
まずは陽極側のCl–が電子を投げます。
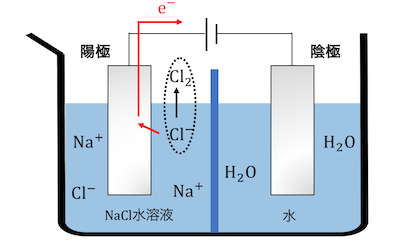
電子が陰極側に送られ、水と反応します。
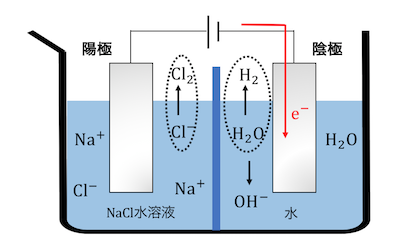
すると陽極側と陰極側で電荷がずれてしまいます。
陽極側が+に、陰極側が-になるので、
左から右に電場が生じます。
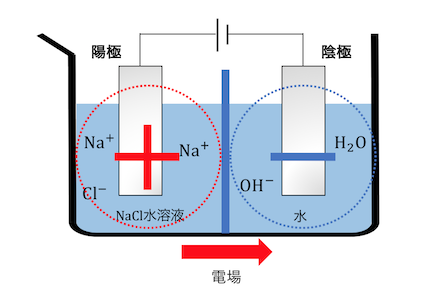
ここで先ほど説明した陽イオン交換膜が働きます。
電場によってNa+は右に、OH–は左に動きますが、
陽イオン交換膜はNa+しか通しません。
これによってNa+だけが移動して電荷が調整されます。
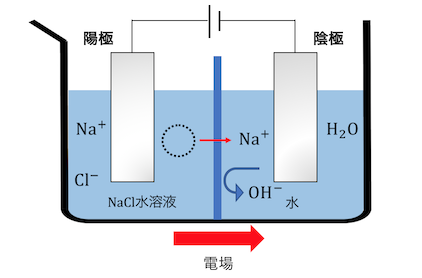
これによって陰極側の溶液に水酸化ナトリウムができました。
酸性:2H++2e–→H2
中性:2H2O+2e–→H2+2OH+
のように酸性の場合と本質は同じです。
実際のイオン交換膜法
実際に工業的製法で用いる電解槽を見てみましょう。
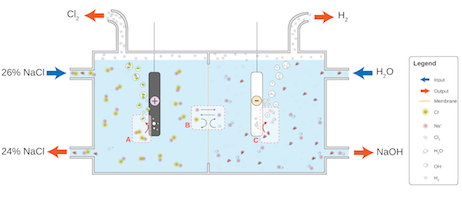
(Chloralkali membrane.svg by Jkwchui in wikipediaより)
このような仰々しい装置で出題されますが、
本質はビーカーと同じです。
この電解槽全体で、
と言う反応を起こし、
目的のNaOHと副産物のH2、Cl2を得ます。
参考:陽イオン交換膜
陽イオン交換膜について簡単に補足しておきます。
まだ有機化学を勉強していない人は飛ばしてしまって構いません。
「陽イオン交換膜」とは、
有機化学で学習する「イオン交換樹脂」を膜状にしたものです。

(画像:イオン交換樹脂)
陽イオン交換樹脂の一例をあげてると、
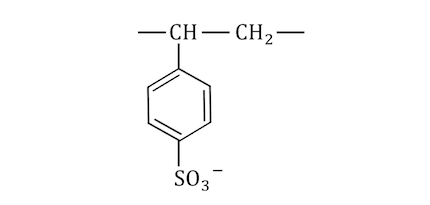
のような構造をしています。
スルホ基-SO3–が陰性なので陰イオンは近づけませんが、
陽イオンは以下のように反応できます。
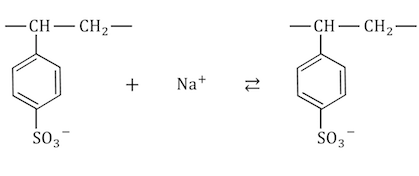
陽イオンを掴んだり離したりする性質を利用して、
陽イオンだけを通す陽イオン交換膜を作っているのです。
まとめ
今回は水酸化ナトリウムの工業的製法である、
イオン交換膜法について解説しました。
イオン交換膜法はただの電気分解ですが、
陽イオン交換膜をうまく利用して水酸化ナトリウムを生成していたのでした。
きちんと理解すればもう忘れないはずです。
不安がある場合はもう一度復習しておきましょう。













イオン交換膜法の記事↓
http://www.jukenmemo.com/chemistry/inorganic/ion-exchange/
ここの実際のイオン交換膜法という題での文章↓
この電解槽全体で、
2NaCl+H2→2NaOH+H2+Cl2
と言う反応を起こし、
目的のNaOHと副産物のH2、Cl2を得ます。
この反応式の左辺において、水素ではなく水ではないでしょうか?