酸化還元反応の半反応式は、
作り方を理解していればその場で作ることができます。
ただし酸化剤がどんな生成物になるか、
還元剤がどんな生成物になるか、
に関しては覚えるしかありません。
ここでは酸化還元反応の生成物をまとめます。
ここにまとめたものさえ覚えておけば、
入試レベルでは困らないでしょう。
この記事ではさらに、
いわゆる酸化数直線の考え方なども紹介します。
酸化還元反応を理解している人にとっては、
より深く現象を理解していけるでしょう。
酸化剤・還元剤まとめ
①酸化剤(電子を奪いたい)
MnO4–→Mn2+(酸性)
MnO4–→MnO2(中性・塩基性)
MnO2→Mn2+
Cr2O72-→2Cr3+
H2O2→2H2O
濃HNO3→NO2
希HNO3→NO
熱濃H2SO4→SO2
②還元剤(電子を与えたい)
H2S→S
H2O2→O2
(COOH)2→2CO2
SO2→SO42-
2S2O32-→S4O62-
イオン化傾向の高い金属→陽イオン
(スマホの画面に収まるようにしてあるので、
スクショしておくと便利です。)
一度この表の反応全てについて、
半反応式を立ててみるといいでしょう。
一度半反応式を立てておくと、
意外と生成物は頭に残るものです。
答え合わせができるように、
このページの最後に完全な反応式も記しておきます。
また、まだ半反応式の作り方が不安な場合は、
以下の記事をチェックしておきましょう。
なぜ酸化剤(還元剤)になるのか
酸化還元反応が発生するのは、
酸化数が普段より大きく変化してしまったときに、
元の状態に戻ろうとする力が原因でした。
だから同じ元素であっても、
酸化数が大きいか小さいかによって、
酸化剤にも還元剤にもなりえます。
たとえば硫黄Sは、
濃硫酸H2SO4であれば酸化剤ですが、
硫化水素H2Sであれば還元剤ですね。
酸化剤になるのか還元剤になるのかは、
以下のような数直線から定性的に考えることができます。
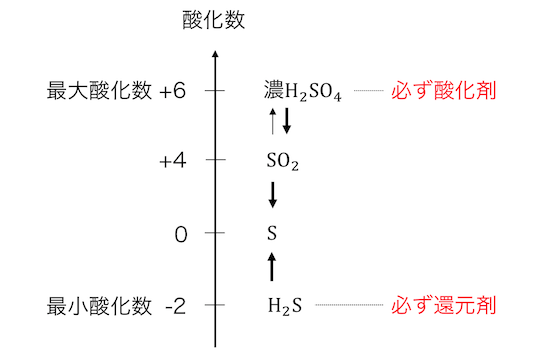
硫黄を例に考えます。
硫黄の価電子は6個なので、
電子を奪われるにしても最大6個まで、
逆に電子を奪うにしても最大2個までです。
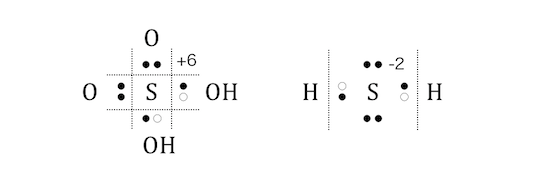
つまりある元素の酸化数は、
+(価電子数)が最大の酸化数、
-(8-価電子数)が最小の酸化数になるということです。
これを考えれば、
濃硫酸は酸化剤にしかなりえませんし、
硫化水素は還元剤にしかなりえませんね。
また二酸化硫黄は普通は還元剤として働きますが、
硫化水素に対しては酸化剤になります。
もうひとつ別の例を見ましょう。
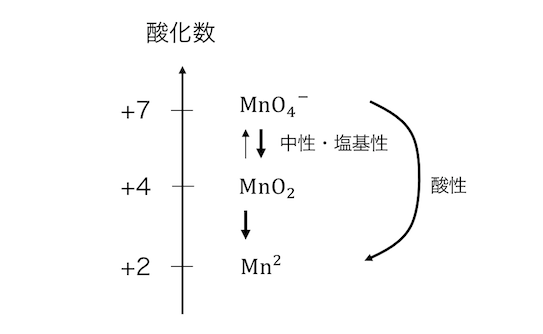
過マンガン酸イオンは中性では二酸化マンガンに、
酸化力の強い酸性ではマンガンイオンになります。
酸化力が強いほど酸化数が大きく変化しているのがわかります。
また二酸化マンガンは中途半端に酸化数が小さくなっているので、
二酸化マンガンからさらに反応を進めるには酸性であっても加熱が必要になります。
参考(過酸化水素他)
過酸化水素は、
「酸化剤だがより強い酸化剤には還元剤として働く」
と説明されることが多いです。
ここで酸素について酸化数直線考えてみましょう。
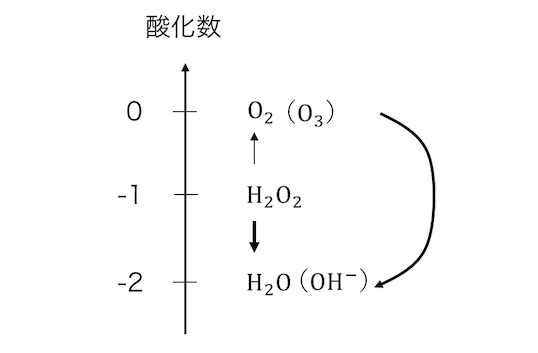
酸素は電気陰性度的にも2-の状態が安定ですから、
過酸化水素が酸化剤になるのは理解できそうです。
さらに酸化数-1から0になる可能性はありますから、
還元剤として働きうるのもわかりますね。
しかしいくら強い酸化剤が相手だからとはいえ、
例えば二酸化マンガンが還元剤になって、
過マンガン酸イオンになるのは考えにくいです。
なぜ過酸化水素だけこんなことが起こるのでしょう。
これについては、
過酸化水素が還元剤として働く場合を、
いくつか見てみるとよいでしょう。
→ K2SO4+2MnSO4+8H2O+5O2
O3+H2O2 → H2O + 2O2
Ag2O+H2O2 → 2Ag + H2O + O2
この例からわかるように、
過酸化水素が還元剤として働く場合には、
いつも相手に酸素原子がいます。
過酸化水素のO原子1つと酸化剤のO原子1つから、
1つの酸素分子ができていることがわかります。
つまり過酸化水素は単に還元剤と働くというよりも、
相手に不安定な酸素を押し付けることで、
自身が安定になろうとしていると考えることもできます。
またあまり出題されることはありませんが、
チオ硫酸イオンの半反応式が問われることもあります。
これらを構造式で書くと以下の通り。
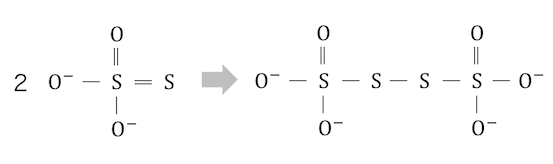
硫黄は酸素と同じく16族で原子価が2ですから、
次々と繋がった構造になっているのですね。
まとめ
今回は酸化還元反応の生成物をまとめました。
まとめた反応の半反応式を立ててくれた人のために、
完全版のまとめも用意しておきましょう。
①酸化剤(電子を奪いたい)
MnO4–+8H++5e–→Mn2++4H2O(酸性)
MnO4–+2H2O+3e–→MnO2+4OH–(中性)
MnO2+4H++2e–→Mn2++2H2O
Cr2O72-+14H++6e–→2Cr3++7H2O
H2O2+2H++2e–→2H2O
濃HNO3+H++e–→NO2+H2O
希HNO3+3H++3e–→NO+2H2O
熱濃H2SO4+2H++2e–→SO2+2H2O
②還元剤(電子を与えたい)
H2S→S+2H++2e–
H2O2→O2+2H++2e–
(COOH)2→2CO2+2H++2e–
SO2+2H2O→SO42-+4H++2e–
2S2O32-→S4O62-+2e–
(金属陽イオンは省略)
完全版をわざわざ最後においたのは、
酸化還元反応の作り方を理解せずに丸暗記するのを防ぐためです。
復習の際にはぜひ最初のまとめを見てください。














チオ硫酸イオンの半反応式に出てくる左辺と右辺の物質の酸化数について
左辺の硫黄は酸化数+2、酸素の酸化数は-2、だとわかりますが、右辺の硫黄の酸化数が+2.5、となってしまいます。
構造式を参考に電子式を考えてみたのですが上手く書けずわかりませんでした。
教えていただけると幸いです。
コメントありがとうございます。
そこはかなり迷いやすいところですよね。
以前YouTubeで説明したことがあったので
リンクを共有しておきます。
https://youtu.be/xSsgiwHXKwo
(たしか説明は動画の後半の方)
ぜひ見てみてくださいー。
誤植を見つけたかもしれないので確認してほしい
http://www.jukenmemo.com/chemistry/theory/or-products/#comment-370
↑の記事において
なぜ酸化剤(還元剤)になるのか、という題で
文章
酸化数になるのか還元剤になるのかは、
以下のような数直線から定性的に考えることができます。
ここの部分のはじめの「酸化数」というところは酸化剤だと思います
ほんとですね…!
間違えていました。
ご指摘ありがとうございます、
訂正しておきましたー。