「共有結合は非金属どうしで強い結合」
「イオン結合は、えっと、なんだっけ…」
「金属は電気が流れて、展性・延性があって…」
あなたもこのように、
「化学結合」で苦労したことはありませんか?
化学結合は一見覚えることが多いため、
なんだかんだセンター試験の選択肢などでも、
迷ってしまうことが多いです。
化学結合で混乱してしまうのは、
化学結合が「なぜ起こるか」を本質的に理解していないからです。
ここでは化学結合について説明しますね。
ここの内容を理解すると、
「え、化学結合って覚えることないじゃん!」
と思えるようになり、もう絶対にテストで間違えなくなります。
理解度の差に驚かれると思います。
高校化学で大事なのはとにかく「仕組み」を考えること。
化学結合の時点で丸暗記なんかしていたら、
この先ずっと丸暗記地獄になってしまいます。
ぜひ最後まで読んでみてください。
目次
化学結合とは
「化学結合」とは、化学物質内で原子同士を結びつける結合のことです。
教科書には化学結合の種類として、
・共有結合
・イオン結合
・金属結合
・分子間力による結合
が出てきます。
これらの性質は以下のようにまとめられます。
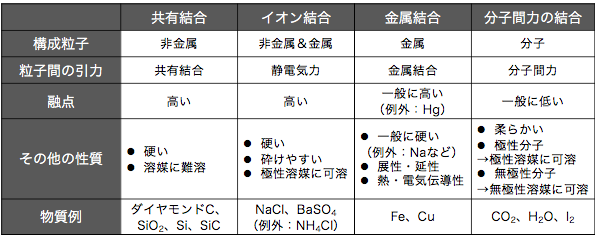
「これを全部覚えるのか…」
なんて風に思ってはいけません。
こんなの覚えられるわけがないので、
きちんと仕組みから理解していきましょう。
化学結合の種類
まずは素朴にこのような結晶があったとしましょう。
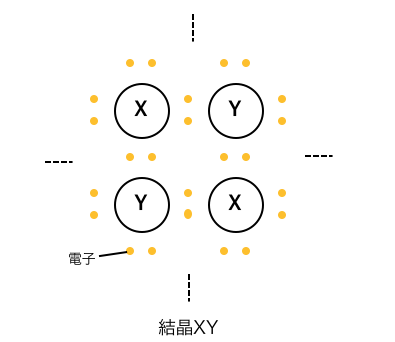
これらの結合の性質を知るために、
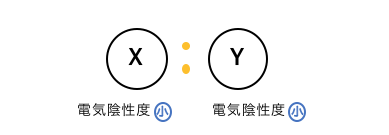
X原子やY原子がどれだけ電子対を引っ張っているか、
を考えていきましょう。
分子内の原子が電子対を引っ張る強さは、
「電気陰性度」を考えればよいのでした。
それではXYの化学結合の仕組みを確認していきましょう。
【合わせてチェック】
・電気陰性度とは?電気陰性度で高校化学を理解しよう!
共有結合
まずはXとYの電気陰性度が、
共に大きいような場合を考えてみます。
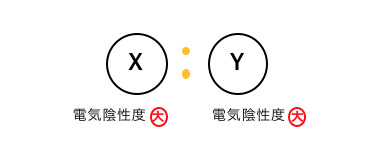
電気陰性度が強い原子は、
電子を引っ張りたがる原子だということです。
よってこの場合、
XとYが両方電子対を強く引っ張ります。
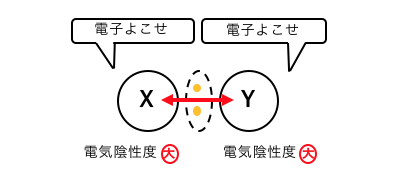
このように強い力で引っ張りあって、
電子対を共有する結合のことを「共有結合」といいます。
共有結合を作る原子はお互いに電子を引っ張り、
ガッチリと固い結合を作ります。
このように考えれば、
「強い結合」という共有結合の性質は当たり前ですね。
さらに「電気陰性度の大きい原子」について考えてみましょう。
電気陰性度は周期表の右上にあるものほど大きいのでした。
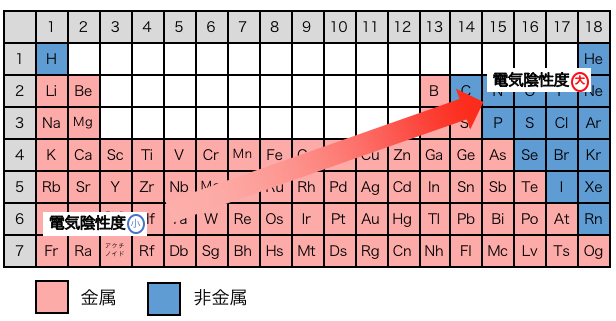
この周期表の図からわかるように、
電気陰性度が大きい原子とは主に「非金属」を指します。
以上のことから、
電気陰性度の大きいもの同士≒非金属同士の結合は、
強く引っ張り合うことで強力な共有結合を作る、
と言うことがわかりますね。
一方ハロゲンの中でも最も電気陰性度の強いFとの結晶AgFは、十分に電気陰性度差があるのでイオン化して水に溶けます。
イオン結合
次に、XとYの電気陰性度が、
Xが大きくYが小さいような場合を考えてみます。
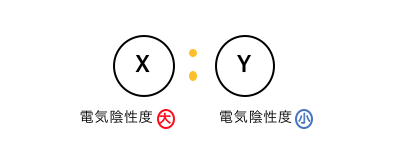
この場合はX原子ばかりが電子対を引っ張るということです。
その結果、
Xは電子対を自分のものにしてしまいます。
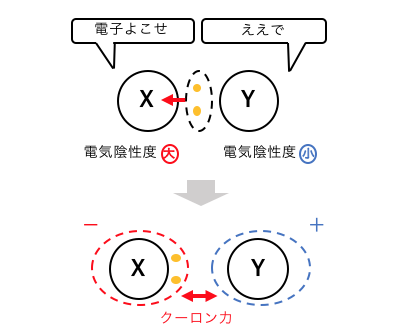
するとXは陰イオン、Yは陽イオンになり、
お互いの間に「クーロン力」が働きます。
このクーロン力による結合が「イオン結合」です。
クーロン力はとても強い力なので、
イオン結合もかなり固い結合です。
ただし結合自体は固いですが、
結晶は割れやすいことに注意しましょう。
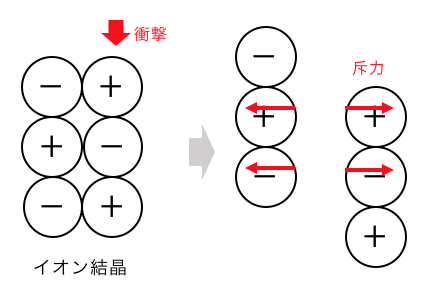
横から衝撃を与えると、
クーロン力が逆向きに働いてしまうのですね。
また、共有結合のときと同様に考えると、
イオン結合は「金属と非金属」による結合です。
金属結合
最後に、XとYの電気陰性度が、
共に小さいような場合を考えてみます。
このときXにもYにも電子への執着がないですから、
電子対が「自由電子」となって動き出します。
これによってたくさんの原子でたくさんの電子を共有することになります。
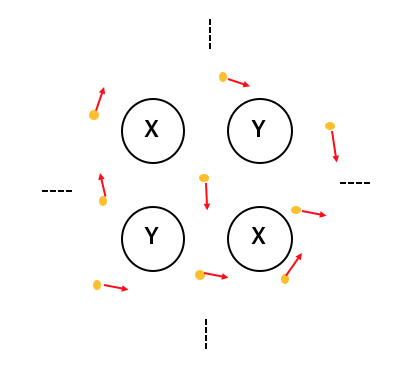
このように複数の原子で電子を共有する結合を「金属結合」といいます。
今までの説明の通り、
電気陰性度が弱い「金属同士」が結合するため金属結合というのですね。
金属結合の性質は少し複雑なので、
順番に見ていきましょう。
①結合の固さ
金属結合はみんなで電子を共有することで、
一般には強い結合になっています。
「金属結合=複数原子による共有結合」
と考えれば結合が固い理由がわかるのではないでしょうか。
ただし実際はたくさんの原子と電子が関わるため現象は複雑で、
金属ごとに結構性質が変わってきます。
例えば鉄などの金属はかなり固いイメージがありますが、
ナトリウムはナイフで切れてしまいますよね。
このように一概には言えませんが、
一般的には金属は強い結合になっています。
【合わせてチェック】
・有機化学の基礎!アルカン・アルケン・アルキンとは?
②展性・延性
金属結合は複数原子で複数電子を共有しているので、
1つ1つの原子や電子の場所は重要ではありません。
だから金属を叩いたり引っ張ったりすると、
壊れたりすることなく薄く伸びることができます。
このように叩くと薄く広がる性質を「展性」、
引っ張ると細長く伸びる性質を「延性」といいます。
③熱・電気伝導性
金属結合には自由電子が存在するため、
それを電気や熱を伝えやすいです。
電圧によって電子が動くため電気伝導性があり、
熱によって一部の電子が動き出し、
他の電子にもぶつかってエネルギーを伝搬するため、
熱伝導性があります。
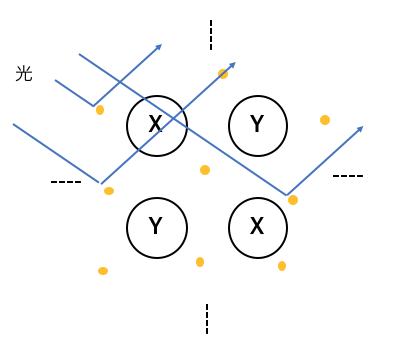
④金属光沢
金属に光をあてると、
自由電子が光を跳ね返すことで光を反射します。
これによって生まれるのが「金属光沢」です。
分子間力による結合
ここまで説明してきたのは全て分子内の結合ですが、
分子間力による結合だけが分子間の結合です。
だから本質的には全く別物なのです。
分子間力による結合は電気陰性度ではなく、
「ファンデルワールス力」や「水素結合」などの、
分子間力によって作られています。
以下では簡単にファンデルワールス力と水素結合の補足をしておきます。
ファンデルワールス力
例えば共有結合の分子を考えてみましょう。
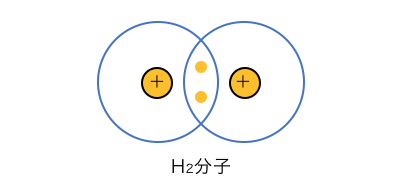
電気陰性度の強いもの同士の結合といえど、
電子がずっと同じ場所にいるとは考えづらいですね。
実際には2つの原子の周りを動き回っています。
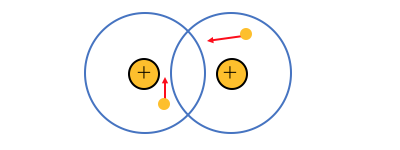
すると例えばある瞬間、
電子が片方に偏ったりすることがありますね。
この微妙な電子の偏りによって、
分子同士が引き合うのが「ファンデルワールス力」です。
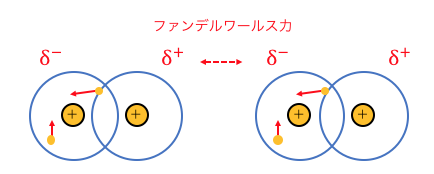
ある瞬間にファンデルワールス力が生じても、
次の瞬間には無くなってしまうかもしれません。
これからもわかるように、
ファンデルワールス力はとっても弱い力です。
水素結合
電気陰性度の強いもの同士の共有結合でも、
多少電気陰性度の差がある場合がありますね。
これによって生じるのが「極性」です。
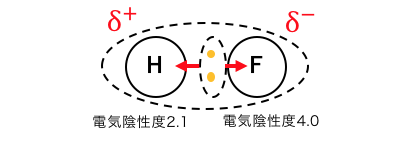
極性が大きすぎるせいで、
分子同士に引力が生じてしまってできるのが「水素結合」です。
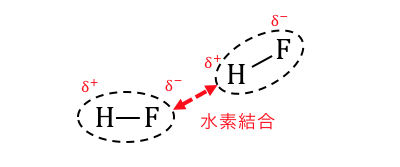
水素結合は明確に電荷が偏ってできるので、
ファンデルワールス力に比べれば圧倒的に強い力になります。
分子間力による結合の性質
分子間力は分子内の力に比べて小さいため、
分子間力による結合は弱い結合です。
そのため他の結晶に比べても、
分子結晶はとっても脆いのです。
まとめ
最後にそれぞれの結合の性質をまとめておきましょう。

ここまで読んでくれたあなたなら、
この表を見ても「覚えよう!」とはおもわず、
「当たり前だな」と思うのではないでしょうか。
このように、
ただ丸暗記するよりも少しだけ時間をかけて、
「仕組み」をよーく考えてあげることで、
圧倒的に深く理解することができます。
ほんの少し時間をかけるだけで、
「もう化学結合は一生忘れないな」
と言う状態になれるんです。
化学結合に限らず高校化学には「仕組み」が溢れています。
他の記事を読んで、深く理解してみてください。














コメントを書く