多くの受験生は化合物の物性を丸暗記しています。
もしくは物性を理解した気になっています。
例えばNaOHはなぜ塩基性なのでしょうか?
「OHがあるから!」
と答えたくなるかもしれませんが、
同じ形をしたCH3OHが中性なんだから論理的な説明じゃないです。
実はほとんどの受験生は、
NaOHが塩基性であることを理解できていません。
これでは勉強すればするほど新しい化合物が出てきて、
その度に丸暗記をする必要が出てきます。
しかし適切な考え方をすることで、
化合物を見ただけで大まかな性質がイメージでき、
化学の丸暗記地獄から解放されます。
受験生のほとんどは化学を暗記科目だと思っていますから、
この記事を読むだけでも他の受験生よりも一歩前に進めます。
今回はOHを含む化合物に注目して考えてみます。
XOH型
前回上げた結晶についての記事を読みましたか?
今回も同じような考え方が出てくるので、
まだ読んでいない人は是非読んでみてください。
【合わせてチェック】
・イオン結合?共有結合?~高校化学は電気陰性度だけで考える!?~
結晶と同様に、本質的な理解をするためには
やはり原子レベルで考えていく必要があります。
例えば以下のようなXOHという化合物を見てみましょう。

これを見ただけで塩基性と思ってしまう人は、
丸暗記脳になってしまっている可能性が高いです。
以下のように電離すればこの化合物は酸性にもなります。
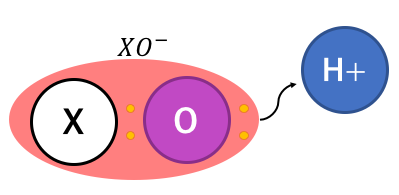
化合物で起こる現象を説明するためには、
それより小さい単位、原子で考える必要があります。
原理原則は電気陰性度
化合物中の原子の影響は、
もちろん電気陰性度を使って考えます。
まずは基本的な関係を見てみます。
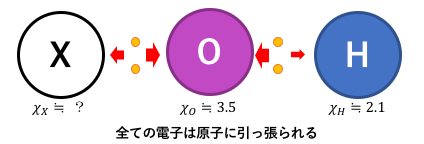
共有電子対は当然全ての原子に引っ張られた状態です。
電気陰性度が全物質中2番目に強い酸素は、
ちょっと強く引っ張っていることにも注意しましょう。
化合物の物性は共有電子対の状態によって決まります。
そこで物性を考えるためには電気陰性度の大小を比べればいいわけですが、
酸素は電気陰性度が非常に高いので、
結局はXとHの電気陰性度を比較すればよいです。
ということで
・Hの電気陰性度が大きい場合
・Xの電気陰性度が大きい場合
に分けて考えましょう
Hの電気陰性度が大きい場合
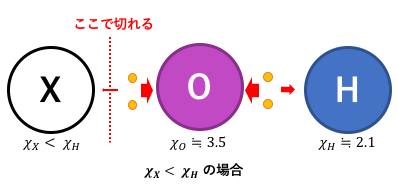
Hの電気陰性度が大きいとすれば、
HとXではXの方が離れやすいです。
上の図を見るとわかりやすいでしょう。
よってこの場合はX+とOH–に別れて塩基性になります。
さらに,今回はXの電気陰性度が小さいわけですが、
電気陰性度が小さい=金属だったことを思い出せば、
Xが金属ならXOHは塩基性だとわかります。
一見難しそうな考察でしたが単純な結果になりました。
これでNaOHやCa(OH)2が塩基性だということも、
本質から理解できましたね。
Xの電気陰性度が大きい場合
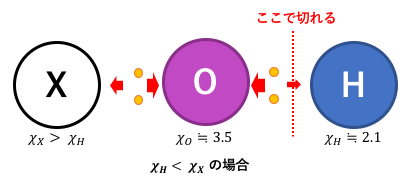
Xの電気陰性度が大きい場合も同じように考えられます。
つまりこの場合はXO–とH+に別れて酸性になります。
そして電気陰性度が大きい=非金属だから
Xが非金属なら酸性だともわかります
つまりClOHなどは酸性になるということですね
ClOHなんて物質は見たことないですか?
順番を入れ替えてHClOとすれば思いだせるでしょうか。
そう,実は次亜塩素酸はNaOHと同じ構造だったんですね。
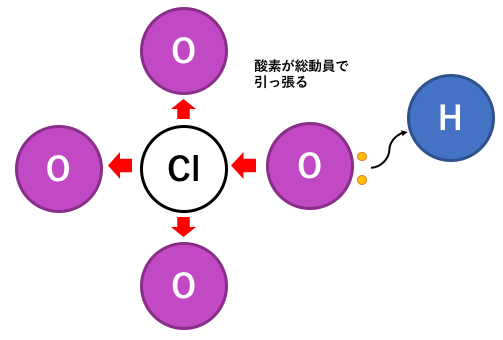
ちなみに以下のような過塩素酸は最強の酸です。
これも電気陰性度を考えれば同じようにわかりますね。
まとめ
XOHを理解できたでしょうか、
人によっては今回新しい内容はなかったかもしれませんが、
新しい考え方は学べたのではないでしょうか
実はこれが高校化学の重要な基礎の1つです
今回出てきた知識は、
NaOHが塩基性であることとHClOが酸性であることだけですが、
不思議ともっと多くのことを学べたと感じるのではないでしょうか。
このような本質的な理解をして初めて、
化学が得意になるための第一歩を踏み出せるわけです
これからもどんどん、
高校の先生が教えてくれない本当の考え方
を教えていきたいと思っています。
もちろん化学に限らずに書いていこうと思っているので、
楽しみにしていてください。














過塩素酸の図の矢印間違ってますよ