中和滴定の計算は比較的早い段階で習うので、
入試本番に落とすことは許されない問題です。
しかし意外と細かい計算に惑わされ、
ミスをしがちな分野でもあります。
中和滴定の問題で計算ミスが起こるのは、
中和滴定の実験手順を正確に理解していないからです。
この記事では中和滴定について解説します。
ここで説明する中和滴定の考え方を理解することで、
もう悩むことなく計算を進めていけるようになり、
テストで無駄な時間を使うこともなくなるでしょう。
今までの理解度との差に驚くことでしょう。
それでは解説していきます。
目次
中和滴定とは
中和滴定とは、
中和反応を利用して、濃度が既知の溶液を使って、
濃度が未知の液体の濃度を知る、
という実験のことです。
中和反応を利用する、というのは、
を利用するということ。
水素イオンと水酸化物イオンがぴったり同じ量のときに、
中和が完了していることを利用したのが中和滴定です。
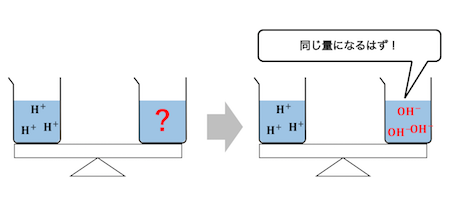
つまり中和滴定は本質的には、
「入れた水素イオンの量」と「入れた水酸化物イオンの量」
の釣り合いを利用しているということです。
中和滴定の計算の流れ
中和滴定の計算の考え方は以下の通り。
中和滴定は全く難しく考える必要はありません。
ただ水素イオンと水酸化物イオンが釣り合っているだけです。
それでは具体例で練習してみましょう。
中和の計算問題
1mol/Lの水酸化ナトリウムは何L必要か。
中和は水素イオンと水酸化物イオンを比べればいいのでした。
まずは水素イオンですが、
硫酸の「つぶ」が1[mol/L]×2[L]=2[mol]、
1つの「つぶ」から2個水素イオンが出るから、
水素イオンは2[mol]×2=4[mol]あります。
次に水酸化物イオン。
わからないものは変数でおくのが基本なので、
水酸化ナトリウムはx[L]としましょう。
水酸化物イオンは、
水酸化ナトリウムが1[mol/L]×x[L]=x[mol]、
1つの水酸化ナトリウムから水酸化物イオンが1個出るから、
水酸化物イオンはx[mol]×1=x[mol]。
それでは水素イオンと水酸化物イオンを比べてみましょう。
4[mol] = x[mol]
よって求める水酸化ナトリウムの量は、
x=4[L]となりました。
中和計算の公式
実際に計算してみてわかったように、
中和計算の公式は以下のように書くこともできます。
= 塩基の濃度(mol/L)×塩基の体積(L)×価数
どの式であっても、
「水素イオンの数と水酸化物イオンの数が同じ」
という意味は変わりません。
そんなあなたは「実験操作の罠」に引っかかっているかもしれません。続けて↓の「中和滴定の実験」をチェック!
中和滴定の実験
中和滴定の計算はとっても簡単なのですが、
実験操作のせいでややこしく感じてしまいます。
中和自体が難しいのではありません。
実験手順の意味をしっかり理解しておきましょう。
滴定の実験手順
中和計算に至るまでの実験操作はこんな感じ。
②その一部をコニカルビーカーに入れる。
③濃度未知の溶液を入れて中和滴定。
この中でも特に①の操作で濃度計算が入るため、
中和滴定が一見ややこしくなります。
①の操作の例としては、
・固体のシュウ酸から水溶液を作る
・食酢を10倍に薄める
などがあります。
前者は正確な濃度の水溶液を作る操作です。
後者は薄めて水素イオンの量を減らすことで、
必要な塩基性の薬品の量を減らすための操作です。
中和滴定のために必要な実験手順に
惑わされないように注意しましょう。
実際の問題を利用して考えてみます。
練習問題
シュウ酸二水和物(式量:126)0.567gをはかりとり、100mLの水溶液とした。この水溶液10mLをコニカルビーカーにとり、濃度未知の水酸化ナトリウム水溶液で滴定したところ12.5mLを要した。水酸化ナトリウムの濃度は何mol/Lか。(化学Ⅰ・Ⅱの新標準演習より引用)
さきほどの、
①濃度既知の溶液を用意する。
②その一部をコニカルビーカーに入れる。
③濃度未知の溶液を入れて中和滴定。
の操作を順にやっていますね。
①から順に考えていきましょう。
まずは濃度既知の溶液を作ります。
シュウ酸水溶液の濃度は、
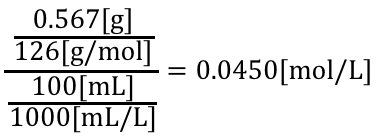
100mLのうち滴定に使うのは10mLです。
ここまでの操作でやっと中和滴定の準備ができました。
ここからはただの中和反応の計算です。
シュウ酸水溶液の濃度と使う量がわかったので、
水素イオンの数を数えてみましょう。
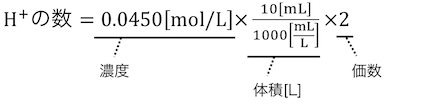
求めたい水酸化ナトリウムの濃度をx[mol/L]とすると、
水酸化物イオンの数もわかります。
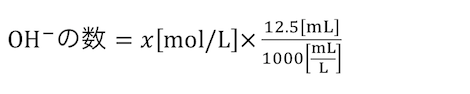
水素イオンと水酸化物イオンが釣り合うことから、
xが求まります。
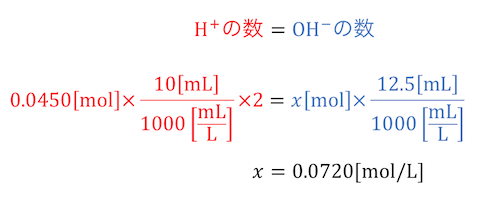
実験器具・指示薬の使い方
最後にセンター試験でも頻出である、
中和滴定の実験器具についてまとめておきます。
実験器具の使い方
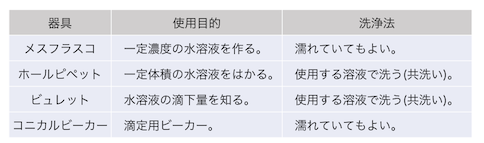
細かく説明していきましょう。
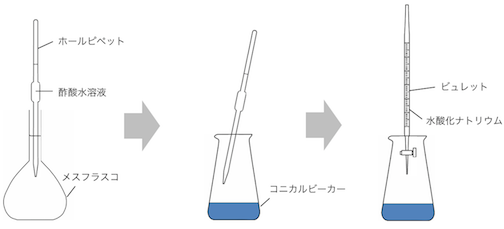
酢酸水溶液を水酸化ナトリウム水溶液で滴定する場合を考えてみます。
酢酸は薄める必要があるのでした。
まずはホールピペットで一定体積の酢酸をとります。
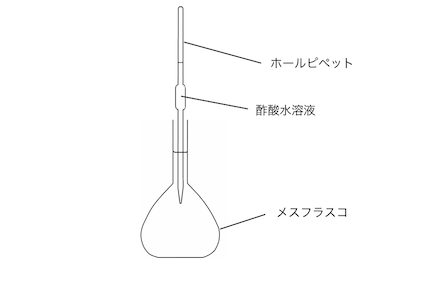
ホールピペットの中身に水があれば濃度が変わるので、
ホールピペットは「共洗い」します。
はかった酢酸をメスフラスコで薄めます。
メスフラスコにはどうせ水を入れるのだから、
蒸留水で洗っても大丈夫です。
次に滴定用のビーカーであるコニカルビーカーに、
酢酸水溶液の一部をはかりいれます。
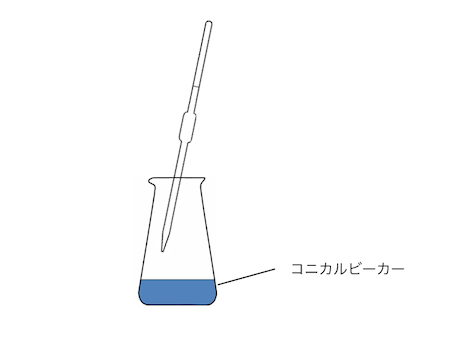
コニカルビーカー内では、
「酢酸を何mol入れたか、水酸化ナトリウムを何mol入れたか」
だけが大事なので、蒸留水で洗っても大丈夫です。
そして最後にビュレットから滴定開始です。
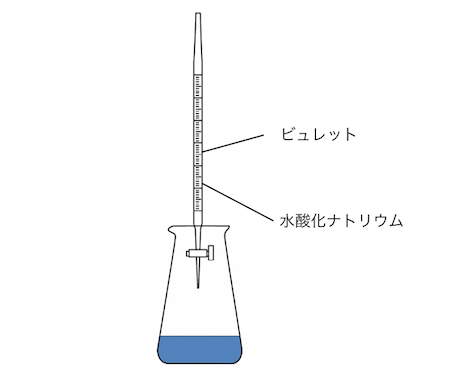
ビュレット内で濃度が変わってはいけないので、
ビュレットも共洗いを行います。
指示薬の色が変わったら滴定終了です。
滴定の流れをまとめるとこんな感じ。
酸塩基指示薬の使い方
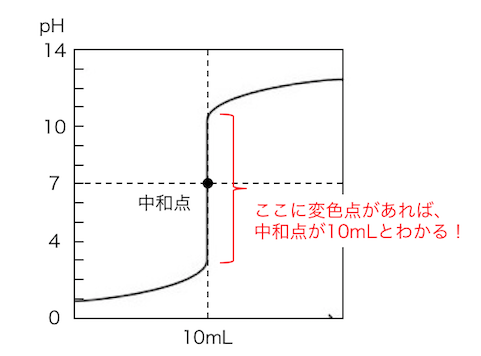
中和滴定において、
標準溶液の滴下量に対するpH変化を表す図を、
滴定曲線と呼びます。
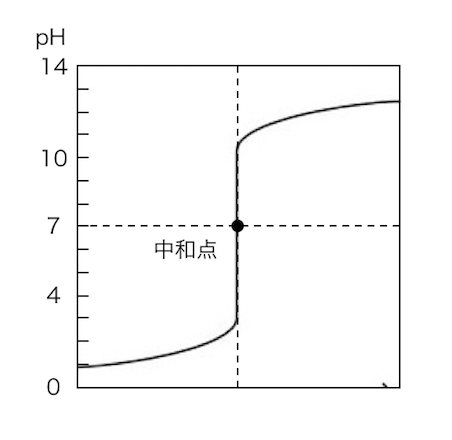
この曲線で中和点となるような標準溶液の量がわかれば、
濃度不明の溶液の濃度がわかるわけですね。
中和点は、一定のpHで鋭敏に色が変わる、
「酸塩基指示薬」によって見定めます。
ただし中和点におけるpHは、
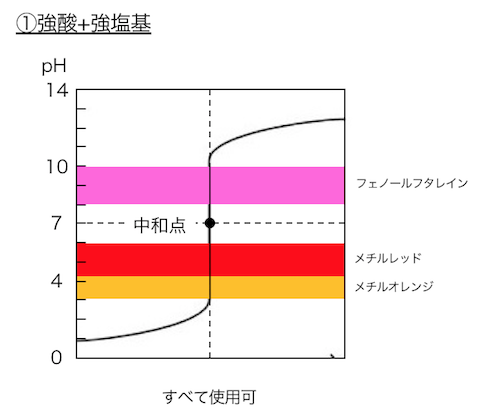
強酸+強塩基であれば中性でpH7ですが、
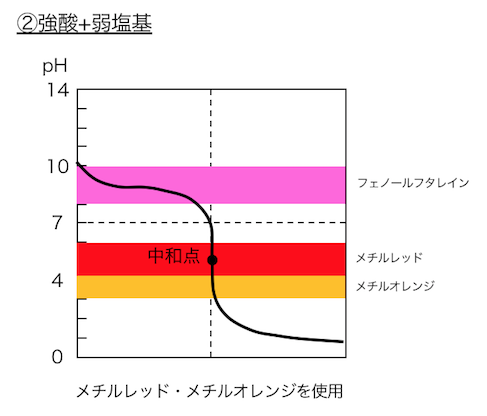
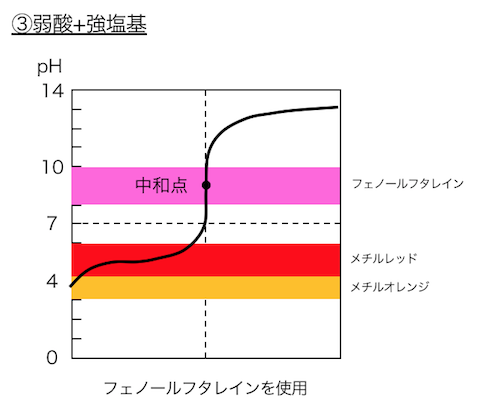
強酸+弱塩基では酸性に、弱塩基+強酸では塩基性に、
中和点がずれています。
そのため使用する薬品によって、
指示薬を変える必要があるのです。
中和は「薬品同士でH+とOH–が釣り合う」というだけで中性という意味ではありません。弱酸や弱塩基があると「塩の加水分解」が起こってpHが動きます。詳しくは以下をチェック。
中和反応の仕組み
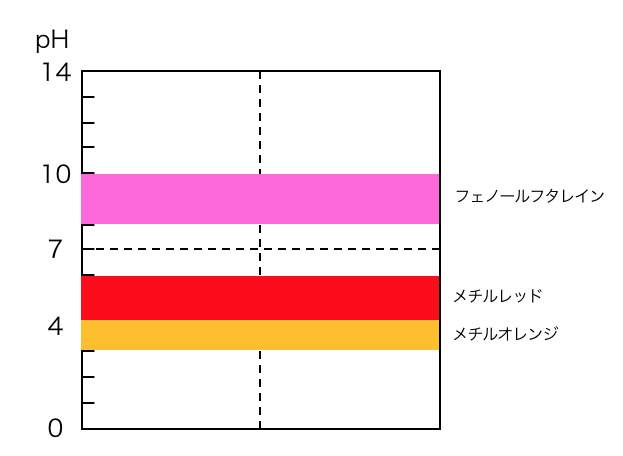
中和滴定で用いる酸塩基指示薬は、
主に以下の3つです。
今求めたいのは、
「中和点のときの標準溶液の滴下量」
でした。
滴定曲線から、
pH変化が激しい「pHジャンプ」に変色域があれば、
中和点を知ることができます。
以上を考慮すると、
①強酸+強塩基
②強酸+弱塩基
③弱酸+強塩基
で用いる酸塩基指示薬は以下のとおりです。
まとめ
ここまで中和滴定の計算や実験手順について解説しました。
①濃度既知の溶液を用意する。
②その一部をコニカルビーカーに入れる。
③濃度未知の溶液を入れて中和滴定。
④中和点の滴下量から、
H+の数=OH–の数
で計算可能。
どこまでが実験のための操作か、
どこからが中和の量的計算かを明確に理解しておきましょう。
中和滴定が必ず得意分野になることでしょう。














コメントを書く