イオン化エネルギー、電子親和力、電気陰性度。
イオン化エネルギーは周期表の左下が小さい、
電子親和力は右上が大きい、
電気陰性度は…。
あなたもイオン化エネルギーや電子親和力が、
頭の中でごちゃごちゃになっていませんか?
これらの言葉がごちゃごちゃになってしまうのは、
物理的に何が起こっているのかをきちんと理解できていないからです。
この記事ではイオン化エネルギーと電子親和力の解説をします。
ここで説明する内容を理解すれば、
もうイオン化エネルギーや電子親和力で混乱することはなく、
センター試験の選択肢も一瞬で判別していけます。
「なんだ、そんなことだったのかー」
と理解できていなかったのが疑問に思えてくると思います。
それでは順番に説明していきますね。
目次
イオン化エネルギーと電子親和力
イオン化エネルギーと電子親和力の説明の前に、
化学の基本的な話をしましょう。
化学で「エネルギー」という言葉を使う場合、
基本的には「必要なエネルギー」のことを指します。
つまり〜エネルギーと言われたら、
何か大変な作業をするために必要なエネルギーということです。
それに対応して、
化学で「熱」という言葉を使う場合は、
「放出するエネルギー」のことを指します。
物体はエネルギーが低い状態になりたがりますから、
ある変化で生じる熱が大きい場合は、
より変化が起こりやすいことを意味します。
これを踏まえてイオン化エネルギーと電子親和力の定義を見ていきましょう。
合わせてチェック:熱化学方程式はエネルギー図で考えろ!
イオン化エネルギーとは
「イオン化エネルギー」とは、
粒子から電子を奪うのに必要なエネルギーです。
どれくらい頑張れば電子を奪えるか、
というのがイオン化エネルギーだということです。
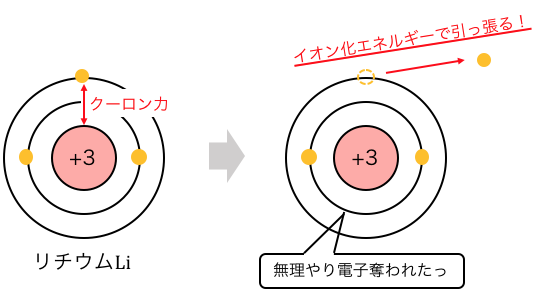
例えば上のLiのイオン化の例では、
以下のような式で表せます。
電子親和力とは
「電子親和力」とは、
粒子に電子を与えたときに放出する熱のことです。
熱を放出するほど安定なわけですから、
電子を与えたときにどれだけ喜んでもらえるかの値ですね。
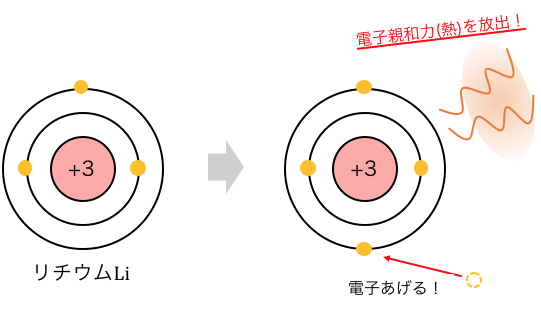
イオン化エネルギーと同じようにLiを例にすれば、
以下のような式になります。
「Li–なんて存在するの!?」
と思ったあなたの感覚は正しいです。
今回は電子親和力の定義に則って考えただけで、
実際にLi–の状態になることは基本的にはありません。
逆に言えばLiは電子親和力が小さく、
電子を与えても喜んでもらえないということになります。
イオン化エネルギーと電子親和力の関係
イオン化エネルギーと電子親和力は、
電子を奪ったり与えたりする点では似ていますね。
先ほどのLiの例を1つにまとめるとわかりやすいと思います。
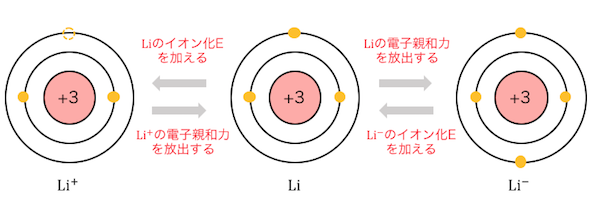
この図からわかるように、
イオン化エネルギーと電子親和力は表裏一体の関係です。
Liのイオン化エネルギーとLi+の電子親和力は等しく、
Liの電子親和力とLi–のイオン化エネルギーは等しいのです。
ただし上の図からわかるように、
Li原子のイオン化エネルギーと電子親和力は別のもの、
ということには注意しましょう。
元素ごとのイオン化エネルギーと電子親和力
これまでLiだけで考えてきましたが、
元素ごとにはどのように変化するのでしょうか。
元素が変化した時にそれぞれがどう変化するか、
周期表を見ながら考えてみましょう。
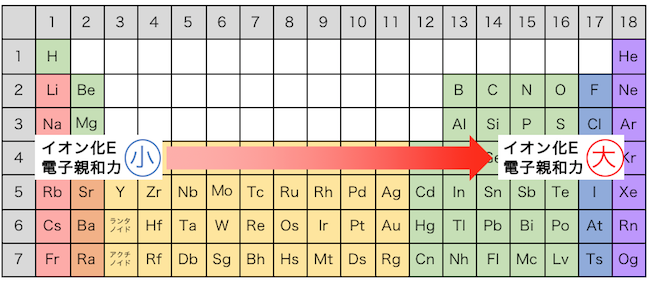
同じ周期の場合
まずは周期表で見たときに、
同じ横軸、つまり同じ周期の場合を考えてみます。
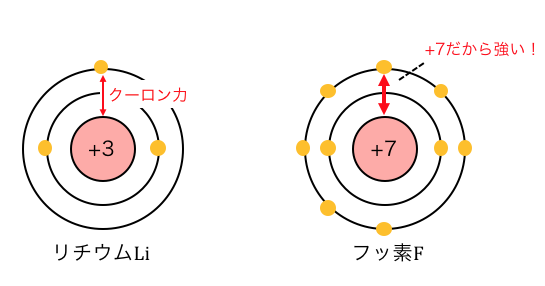
Liは原子核の電荷が+3であるのに対して、
Fは原子核の電荷が+7になっていますから、
強く電子を引っ張っています。
強く引っ張る分頑張らないと電子を奪えないので、
Fの方がイオン化エネルギーが大きくなります。
また全く同じ理由で、
Fは電子を欲しがっているので、
Fの方が電子親和力が大きくなります。
この例からわかるように、
周期表で右に行けば行くほど、
イオン化エネルギーと電子親和力が大きくなります。
同じ族の場合
では同じ族の場合はどうでしょうか。
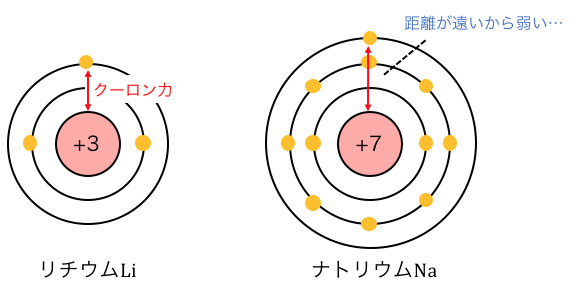
Liでは最外殻がL殻であるのに対し、
Naでは最外殻がM殻になっています。
距離が遠い分原子核からの引力が弱まり、
Naの電子は簡単に奪える状態になっているため、
イオン化エネルギーが小さくなります。
また全く同じ理由で、
Naは電子を与えられても引っ張る力が弱いので、
電子親和力も小さくなります。
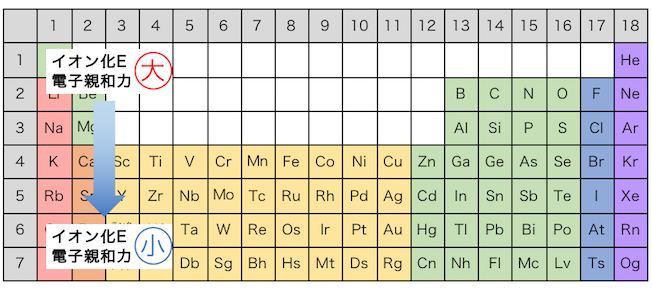
この例からわかるように、
周期表で下に行けば行くほど、
イオン化エネルギーと電子親和力が小さくなります。
物理の電磁気でならいますが、r離れたQ+、Q–の電荷は以下のクーロン力で引き合います。
\(クーロン力=k\frac{Q_{+}Q_{-}}{r^{2}}\)
よって原子核の電荷の影響よりも、半径の影響の方が大きいのです。
さらにいえば、K殻の半径を1とするとL殻・M殻・N殻の半径は4、9、16と2乗増えていきます。結果として半径の影響の方が圧倒的に大きくなるのです。
周期表で見るイオン化エネルギーと電子親和力
以上をまとめるとこのようになります。
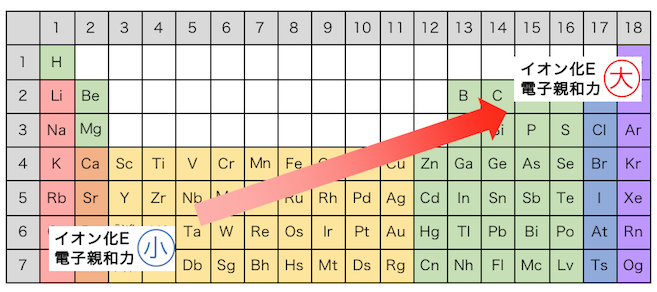
意味を理解していれば難しくないですね。
電気陰性度とは?電気陰性度で高校化学を理解しよう!
まとめ
今回はイオン化エネルギーと電子親和力の説明でした。
イオン化エネルギーとは電子を奪うのに必要なエネルギー、
電子親和力とは電子を与える時に放出する熱、
でした。
実はとってもシンプルな概念ですね。
不安がある場合は必ず上に戻って、
理解できるまで復習してみてください。
また、合わせて「電気陰性度」の記事を読んでおくこともオススメします。
イオン化エネルギーと電子親和力を理解すると、
電気陰性度は簡単に理解できるでしょう。
そして電気陰性度を理解すると、
化学の暗記量が驚くべきほど削減されます。
ぜひ以下をチェックしてみてください。














コメントを書く