電気陰性度、イオン化エネルギー、電子親和力。
化学を勉強し始めた人にとっては、
こんなにいろんな単語が出てきたら頭が混乱してしまいますね。
そんなこともあって、
電気陰性度をきちんと理解している人は少ないです。
しかし実は電気陰性度は、
高校化学の中で最も重要な概念といっても過言ではありません。
いままで、
「化学は暗記ばかりでたいへんー」
「化学式が覚えられなーい」
「化学反応の種類多すぎー」
なんて思ったことはないですか?
こういうことを思っている受験生の多くは、
電気陰性度の意味をしっかり知らないし、
意味を知っていても本当の意味で理解はしていません。
この記事では電気陰性度について解説していきますね。
ここでの内容を身につけることで、
化学のさまざまな現象がすんなりと理解できるようになり、
無機化学や有機化学までが得意科目になるでしょう。
「化学ってそうやって考えるんだ!」
と感じると思います。
もちろんちょっと意味を知るだけでは意味がないので、
ぜひ最後まで読んでみてください。
目次
電気陰性度とは
「電気陰性度」とは、
分子内の原子がどれだけ電子を引っ張るかの尺度です。
言葉ではわかりにくいので以下の図で考えましょう。
XYという分子があったとしましょう。
仮にXの電気陰性度が大きいならば、
共有電子対はX側に引っ張られます。
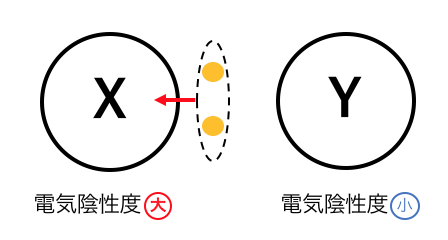
電気陰性度とはこのように、
電子を欲しがる度合いのことを表します。
電気陰性度の大きさ
電気陰性度の意味がわかったので、
次に電気陰性度の大きさが元素ごとにどうなるかを見ていきましょう。
イオン化エネルギー・電子親和力との関係
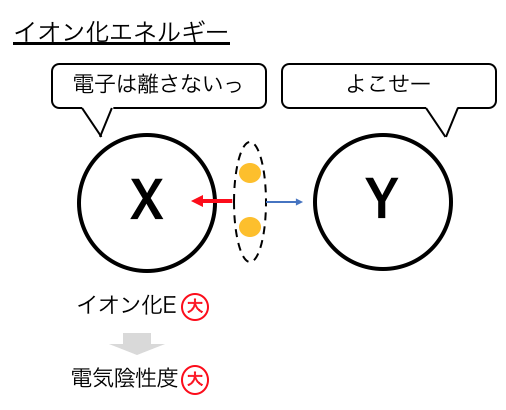
「イオン化エネルギー」は電子を引き剥がすのに必要なエネルギー、
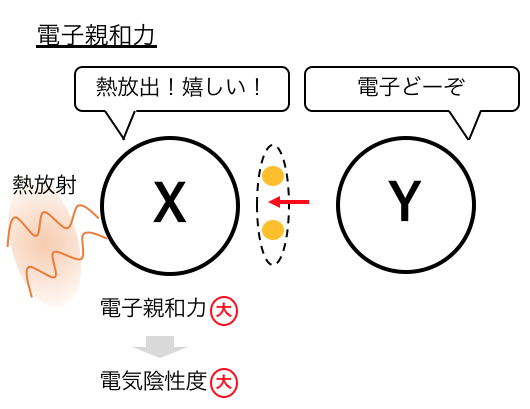
「電子親和力」は電子を取り込む時に放出する熱のことでした。
もし電子を引っ張りたい元素があったら、
電子を引き剥がすのには余分にエネルギーがかかり、
電子を取り込んだときにはより多くの熱を放出します。
つまりイオン化エネルギーと電子親和力が大きいほど、
電気陰性度も大きくなるということです。
これを考慮して電気陰性度の値を定義したのが「マリケンの電気陰性度」です。
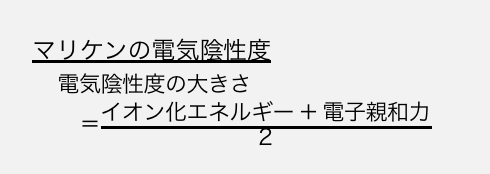
繰り返しになりますが、
電子を引き剥がされたくない
=イオン化エネルギーが高い
=電気陰性度が高い
電子をくれると嬉しい
=電子を受け取るとたくさん熱を放出する
=電子親和力が高い
=電気陰性度が高い
という関係になっているということですね。
周期表で見る電気陰性度
電気陰性度の大きさを周期表で確認してみましょう。
電気陰性度はイオン化エネルギーと電子親和力に比例するのでした。
イオン化エネルギーは右上ほど大きく、
電子親和力も右上ほど大きかったですね。
結局のところ、
電気陰性度は右上ほど大きいということになります。
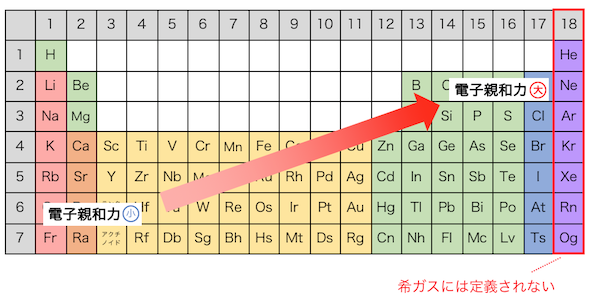
単原子分子で存在する希ガスには、
電気陰性度が定義されていないことに注意しましょう。
電気陰性度の大きさ:
F>O>N=Cl>Br>C>S>H>金属
電気陰性度で考える物性
電気陰性度の意味は理解できましたか?
多くの受験生はここで終わってしまいますが、
むしろここからが本番です。
いくつかの例で、
電気陰性度がどう活躍するのかを見てみましょう。
例1:極性・水素結合
フッ化水素を例に考えます。
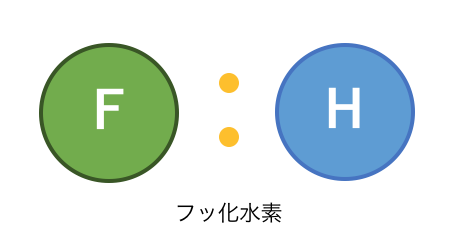
先ほどの電気陰性度の順からF>>Hですね。
よって電子対はフッ素に引っ張られます。
その結果分子内で電荷が偏り「極性」が生じます。
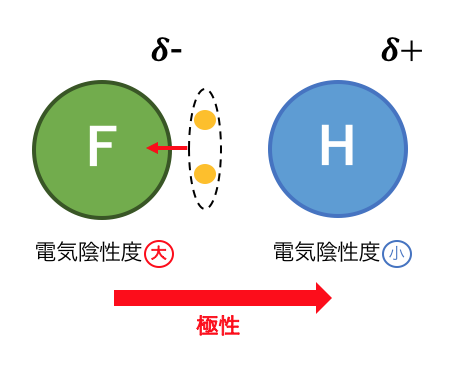
この極性によってフッ化水素は「水素結合」するのでしたね。
例2:XOH型の酸性・塩基性
XOHという物質を考えます。

この物質が酸性か塩基性かも電気陰性度からわかります。
まずはXの電気陰性度がHの電気陰性度よりも小さい場合、
つまりはXが金属の場合を考えましょう。
このときX-Oの結合よりもO-Hの結合の方が強く、
X-Oの部分で電離が起こります。
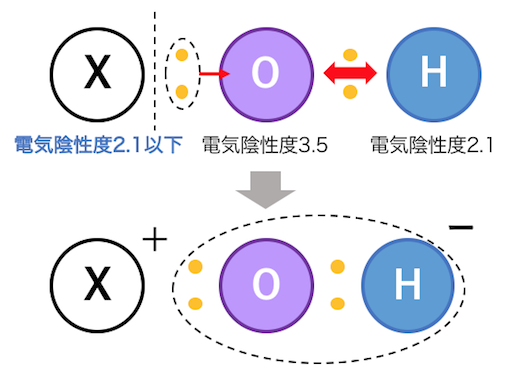
NaOH、KOH、Ca(OH)2などは、
このようにして塩基性になっているのです。
次にXの電気陰性度がHよりも大きい場合です。
同様に考えればO-Hの方の結合が切れますね。
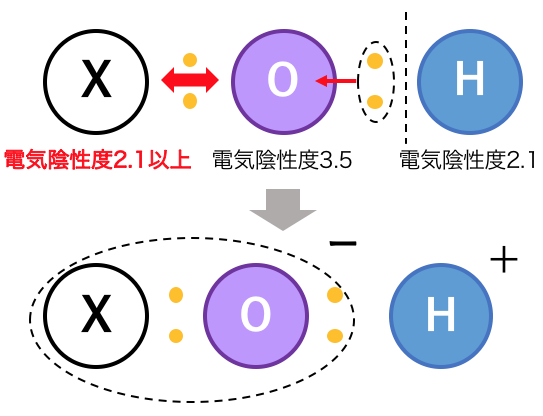
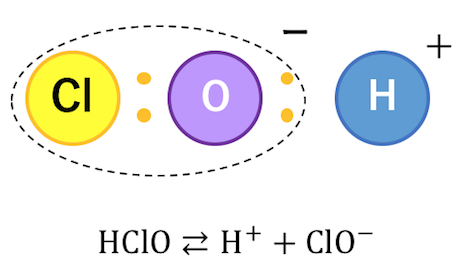
例えば次亜塩素酸HClOは、
Cl>Hなので以下のように電離を起こします。
最後にXとHの電気陰性度が近い場合です。
もう予想できると思いますが、
X-O-Hのどの結合も切れることなく中性になります。
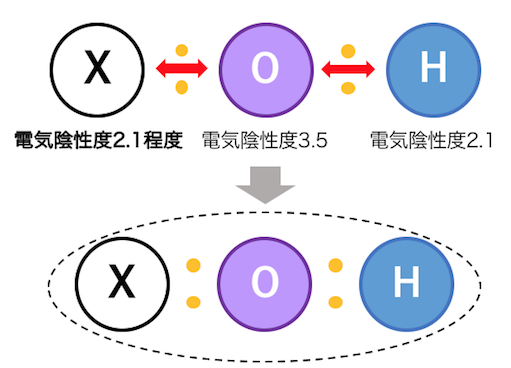
例えばメタノールなどのアルコールは中性でしたね。
例3:酸化還元反応
最後に「酸化還元反応」を考えてみましょう。
過マンガン酸イオンを例に考えます。
過マンガン酸イオンのマンガンは、
周りを電気陰性度の大きい酸素に取り囲まれ、
電子を奪われている状態になっています。
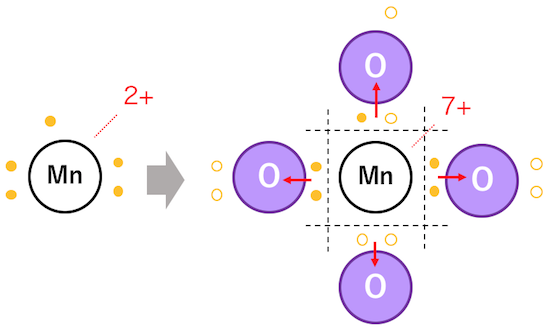
本来のマンガンイオンは+2なのに、
電子を奪われてあたかも+7みたいな状態になっています。
奪われた電子を手にいれるために、
マンガンイオンは周りから電子を奪いにかかります。
ただしこれだけでは、
・電荷が偏っている
・元素の数が偏っている
という問題があるので、周りの物質を利用して以下のように反応します。
酸化還元反応とは電気陰性度の差から、
引き起こされる反応なのです。
酸化還元反応の仕組みを酸化数から理解しよう!
まとめ
今回は電気陰性度の説明でした。
電気陰性度は、
分子内の原子が電子をどれだけ引っ張るか
の尺度でした。
そしてその値は、
イオン化エネルギーと電子親和力に比例するのでした。
後半に電気陰性度で説明できる高校化学を紹介しましたがこれはほんの一部です。
もしこの記事を読んで電気陰性度の意味が理解できたなら、
化学反応や化学結合を電気陰性度で考える癖をつけてみてください。













コメントを書く