ヘンリーの法則は実はめちゃくちゃ簡単なのに、
ほとんどの高校生が一度はつまづいてしまいます。
あなたもヘンリーの法則に出会った時に、
「何が起こってるんだー!?」
と思ったことがあるのではないでしょうか?
ヘンリーの法則がわからなくなるのは、
ヘンリーの法則の説明の仕方が2種類あり、
そのせいで現象のイメージが浮かばなくなるからです。
今回は「何が起こっているか」がイメージできるように、
ヘンリーの法則を解説します。
ここの内容をきちんと理解すれば、
ヘンリーの法則がめちゃくちゃ簡単な問題に見え、
気体の問題がスラスラ解けるようになります。
ぜひ最後まで読んでみてください。
ヘンリーの法則とは
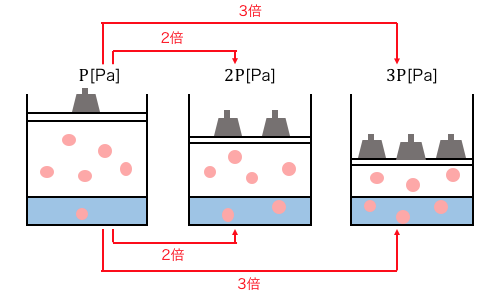
「ヘンリーの法則」とは、
温度と溶媒の量が一定であれば、
溶媒に溶ける気体の物質量は圧力に比例するという法則です。
短い言葉で言えば、
押した分だけ溶ける
ということです。
このように考えるとヘンリーの法則はとても単純です。
1.0×105Paで押して1mol溶けるのであれば、
2.0×105Paで押すと2mol溶ける、というだけですね。
しかしこんなに単純なのに、
かなり多くの受験生がヘンリーの法則でつまずいてしまいます。
なぜそのようなことが起こるのかというと、
実際の問題では「物質量と圧力の関係」ではなく、
「体積と圧力の関係」を問われることが多いからです。
これについて次の章で見ていきます。
【合わせてチェック】
・気体の状態方程式の使い方を徹底解説!
・混合気体の分圧を解説!仕組みがわかれば簡単!
混乱の原因
ヘンリーの法則で混乱する原因は、
先ほどの「物質量と圧力の関係」による定義の他に、
「体積と圧力の関係」による定義があるからです。
一定温度で一定の量の溶媒に対して、
(i)物質量と圧力の関係
溶媒に溶ける気体の物質量は、圧力に比例する。
(ii)体積と圧力の関係
溶媒に溶ける気体の体積は、その圧力のもとで一定になる。
「比例するのか一定になるのかどっち!?!?」
と混乱してしまいそうですね。
しかし冷静に考えてみれば、
実はこれらは全く同じことを言っているんです。
現象がイメージできればとっても簡単なので、
ここから集中して見ていきましょう。
2つの定義の意味
まずは圧力P[Pa]をかけたときに、
物質量n[mol]だけ溶けた場合を考えましょう。
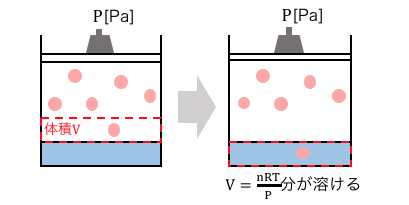
体積\(V=\frac{nRT}{P}\)分の気体が溶媒に溶け込んでいますね。
次に圧力を2倍の2P[Pa]にした場合です。
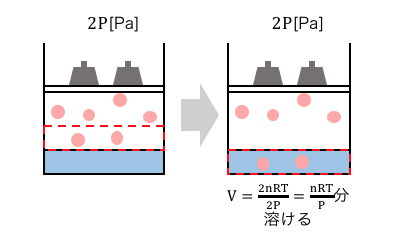
圧力を2倍にすることで、
先ほどの体積Vの場所に2n[mol]の気体が集まってきます。
これは\(V=\frac{2nRT}{2P}=\frac{nRT}{P}\)を考えれば、
わかりますね。
この体積Vの部分が溶け込むことによって、
2倍の物質量が溶媒に溶け込むことになります。
溶ける体積の量は一定だけども、
物質量は圧力に比例していることがわかりますね。
圧力が2倍であろうが3倍であろうが、
結局同じ仕組みで気体が溶けます。
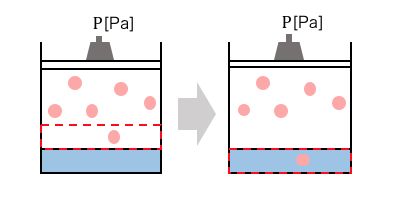
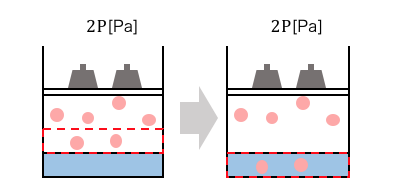
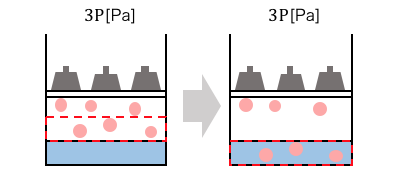
何が起こっているかがイメージできれば、
ヘンリーの法則はめちゃくちゃ簡単ですね。
さらに混乱を与える問題
実はヘンリーの法則がわからなくなる原因は、
もう1つあります。
例えば以下の問題を見てください。
1.0×105PaのCO2の水への溶解度は、水1.0Lに対して27℃で4.5×10-2molである。水1.0Lに対して27℃で2.0×105の圧力をかけると、その体積は1.0×105Paのもとで何Lか。
問題は最後の部分、
「その体積は1.0×105Paのもとで何Lか」
です。
これが何を表しているのかを順番に説明しますね。
まずは2.0×105PaでCO2を溶かします。
これまでに説明した通り、ヘンリーの法則に従って溶けます。
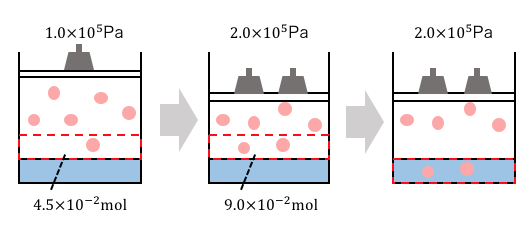
ここまでは先ほどの説明通りです。
しかし最終的に知りたいのは1.0×105Paのもとでの体積。
今の状態では2.0×105Paなので、
溶かした気体を仮に取り出してきたとすると、
それが1.0×105Paで何Lになるかをみる必要があります。
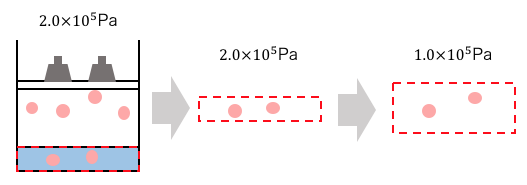
体積と圧力の関係によるヘンリーの法則では、
「その圧力のもとでは一定」となっていますが、
このように見る圧力が変わる場合には成り立たないのです。
圧力が2倍になっているから、溶ける気体の分子量はヘンリーの法則より、
\[
2×4.5×10^{-2}=9.0×10^{-2}mol
\]この物質量の気体の、1.0×105Paのもとでの体積は、
\begin{align*}
V&=\frac{9.0×10^{-2}×8.3×10^{3}×300}{1.0×10^{5}} \\
&=2.24…\\
&≒2.2[L]
\end{align*}
(解答2)
最初の状態で溶けている体積は、
\begin{align*}
\frac{4.5×10^{-2}×8.3×10^{3}×300}{1.0×10^{5}} \\
=1.12…\\
≒1.1[L]
\end{align*}ヘンリーの法則より、圧力を2倍にしても溶けている気体の体積は一定(物質量は変わっている)。
2.0×105Paのもとで1.1L溶けているのだから、1.0×105Paのもとでは、
\begin{align*}
2×1.12…\\
=2.24…\\
≒2.2[L]
\end{align*}
混合気体の場合
もし溶媒に接している気体が混合気体の場合も、
「分圧」で考えていくだけです。
具体的な問題で考えてみます。
混合気体で一見難しそうに見えますね。
でも分圧をしっかり理解していれば、
実は全然難しくないんです。
今、N2の分圧は0.8×105Paだから、
単に0.8×105PaのN2の溶解を考えればいいのです。
同様に、O2の分圧は0.2×105Paだから、
単に0.2×105PaのO2が溶けるのを考えるだけです。
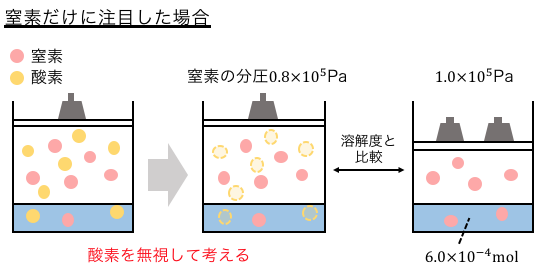
それでは解答を見てみましょう。
N2の分圧は0.8×105Pa。
1.0×105と比べると圧力は4/5倍で、
1.0×105での溶解度は6.0×10-4molだから、
\[
\frac{4}{5}×6.0×10^{-4}=4.8×10^{-4}mol
\]
O2の分圧は0.2×105Pa。
1.0×105と比べると圧力は1/5倍で、
1.0×105での溶解度は1.2×10-3molだから、
\[
\frac{1}{5}×1.2×10^{-3}=2.4×10^{-4}mol
\]
まとめ
今回はヘンリーの法則の解説でした。
ヘンリーの法則は、
「押したら溶ける」という単純な法則ながら、
定義の違いで混乱してしまうのでした。
押した分の粒がたくさん溶けるけど、
その分圧力で圧縮されるから体積は変化しない、
というのが理解できていれば混乱はしないでしょう。
さらにヘンリーの法則が理解できても、
問題形式や分圧が絡むことでややこしくなるので、
実際に問題演習も忘れずにやっておきましょう。














初めてしっかりと理解することができてめちゃくちゃ感動しました…!!
ありがとうございました!!(;ω;)
うれしいコメント!!
化学、難しいけどふぁいと(๑`^´๑)۶
溶媒の量だけを増やしたら、その分だけ溶けますか?