アルコールはいろんな反応を起こして大変…
そんなふうに思っている受験生がかなり多いです。
あなたもアルコールの反応の暗記に困っていませんか?
アルコールの反応がわからなくなってしまう原因は、
反応の仕組みを理解していないからです。
ここではアルコールの反応を仕組みから説明します。
ここの内容を理解することで、
アルコールの反応が全て当たり前の反応に見え、
アルコールの問題がすんなり解けるようになるでしょう。
本質的な理解がないと何度復習しても頭に残りません。
ぜひ読み飛ばさずに読んでみてください。
この記事をたった1回読むだけで、
アルコールの知識の定着度が格段にあがります。
目次
アルコールとは
「アルコール」とは、炭化水素のH原子が
ヒドロキシ基-OHに置き換わった化合物です。
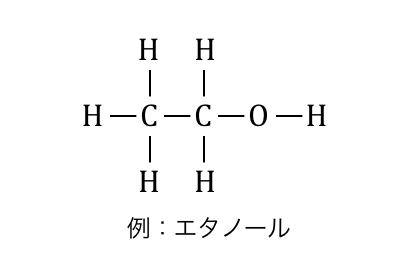
ちなみにエタノールはお酒に入っているアルコールです。
アルコールの分類
アルコールは「価数」と「級数」によって分類します。
「価数」とはアルコールのヒドロキシ基-OHの個数のことをいいます。
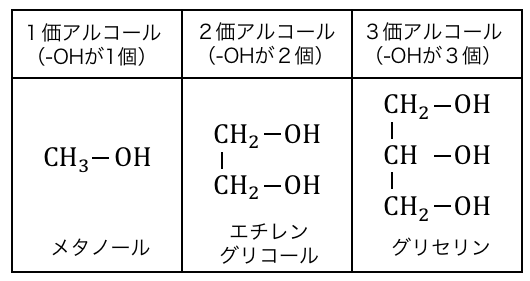
またヒドロキシ基-OHが付いている炭素原子に、
いくつ炭素原子が付いているかを「級数」といいます。
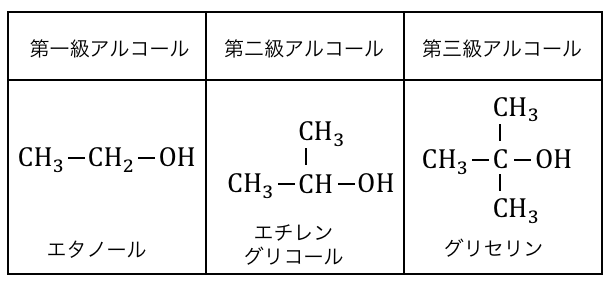
価数は有機化合物の構造決定などで、
級数は酸化反応などで重要になってくるので、
きちんと区別しておきましょう。
アルコールの性質
それではアルコールの性質を見ていきます。
アルコールには-OHが付いているため、
「塩基性にならないのかな?」と思う人もいるでしょう。
そこで以下のように、
「電気陰性度」に注目して見てみましょう。
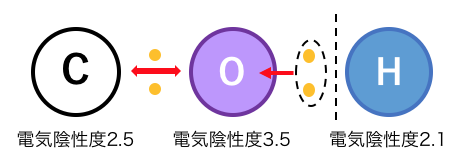
炭素Cと水素Hでは微妙に炭素の電気陰性度が高く、
C-Oの結合よりもO-Hの結合の方が切れやすく、
以下のように電離します。
しかし実際CとHの電気陰性度の差は小さいですね。
例えば強塩基のNaOHのNaの電気陰性度は0.9ですから、
Hの電気陰性度は比較的大きいとわかるでしょう。
そのためアルコールの電離定数は10-15で、
水よりも小さくなるため液性は中性になります。
ただし電離はせずとも、
-OHは水素結合を形成するので炭素数の少ないアルコールなら水に溶けます。
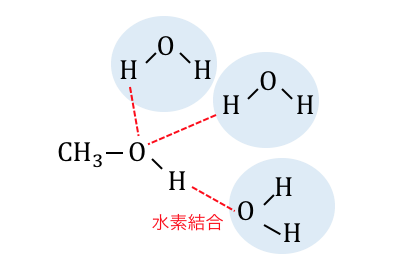
炭素数が増えてくると炭化水素基の割合が増え、
水素結合が減るため水に溶けなくなります。
炭素数1~3くらいまでなら比較的水に溶けます。
アルコールの反応
以上を踏まえてアルコールの反応を見ていきましょう。
反応の仕組みに注意しながら順番に確認しましょう。
ナトリウムとの反応
先ほど説明したように、
アルコールは僅かながら電離しています。
ところでナトリウムはイオン化傾向が高く、
非常に還元性の強い元素でしたね。
ナトリウムは何が何でも電子を投げたいわけです。
そこでナトリウムは、
僅かながら電離している水素に電子を投げつけて、
酸化還元反応を起こします。
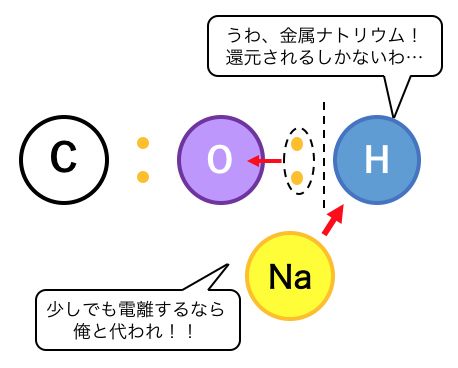
これによってできるC2H5ONaは、
「ナトリウムエトキシド」と言います。
ナトリウムの還元性が強すぎて、
電離度の小さなアルコールに対してさえ、
よくある「金属と酸の反応」が起こってしまうのですね。
これはナトリウムが水に溶ける反応と考え方は同じです。
また一般のアルコールでは以下のように反応し、
その生成物を「ナトリウムアルコキシド」といいます。
Zn+H2SO4→ZnSO4+H2
2ROH+2Na →2RONa+H2
脱水反応
熱濃硫酸を加えて「熱分解反応」を起こすことで、
脱水反応を起こすことができます。
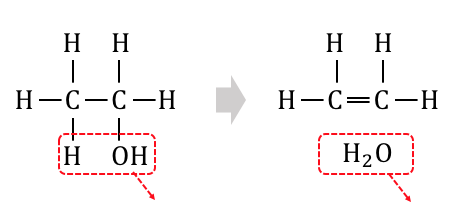
脱水反応は単純な反応ですか、
炭素数の多いアルコールでは注意が必要です。
2-ブタノールの脱水を考えてみましょう。
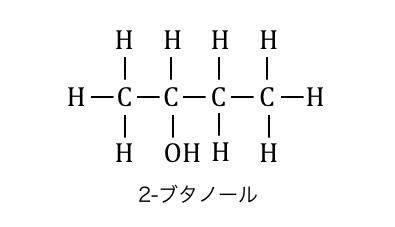
2-ブタノールでは赤枠の部分が脱水されるか、
青枠の部分が脱水されるかの2通りが生まれます。
このとき、水素原子の少ない方の炭素から、
水素を奪って脱水を起こします。
この法則を「ザイツェフ則」と呼びます。
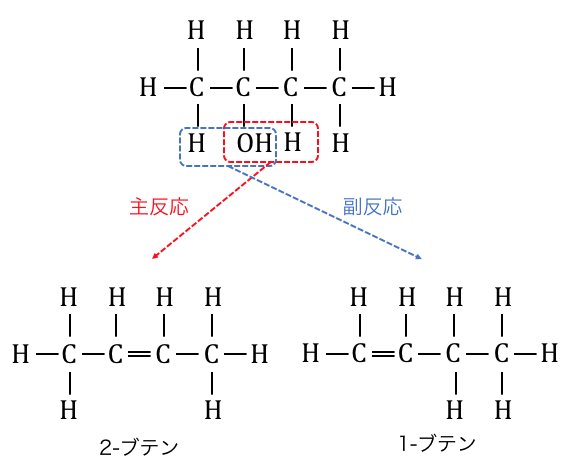
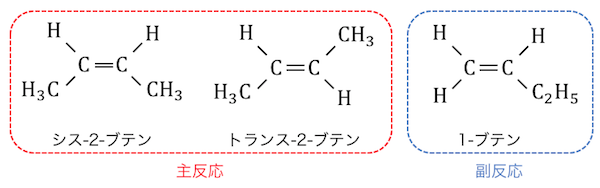
これによって2-ブタノールの脱水反応では異性体が3つできることに注意しておきましょう。
2C2H5OH→C2H5OC2H5+H2O(130℃濃硫酸)
温度が低い方が分子がゆっくり動いているため隣同士で反応する、温度が高い方が分子が速く動いてお隣さんと脱水している暇がないから分子内で脱水する、というイメージですね。
酸化反応
アルコールは「酸化還元反応」を起こすことも可能です。
ただし級数によって反応の様子が変わってきます。
「覚えることがまた増えるのかー…」
と思うかもしれませんが、仕組みを考えれば実は簡単です。
順番に考えていきましょう。
第一級アルコールの酸化
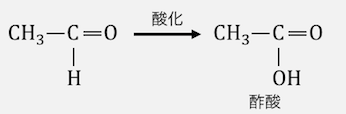
第一級アルコールに酸化剤をいれると、
「アルデヒド」が生じた後に「カルボン酸」が生じます。
この仕組みを見ていきましょう。
酸化剤は電子を欲しがっているので、
アルコールに酸化剤を入れると
ヒドロキシ基の非共有電子対に張り付いてきます。
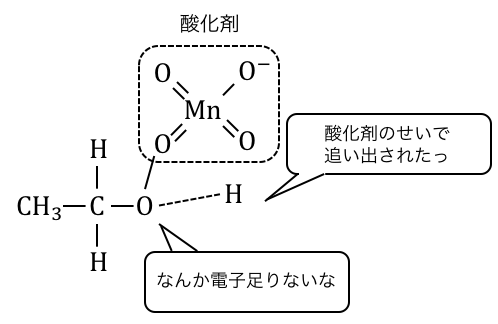
-OHの酸素原子が電子が吸い取られているような状態ですね。
電気陰性度の高い酸素原子は電子が欲しいので、
近くにいる水素から電子を奪い取ります。
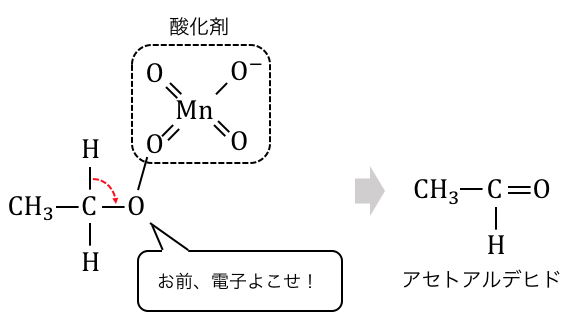
これによってアルデヒドが生じます。
そしてアルデヒドは還元性が強い
という特徴がありました。
よってアルデヒドは酸化剤に即座に酸化され、
カルボン酸が生じます。
合わせてチェック:
アルデヒド・ケトンの反応を解説!
以上の反応の半反応式は以下のようになります(エタノールの例)。
CH3CHO+H2O→CH3COOH+2H++2e–
合わせてチェック:
酸化還元反応の仕組みを酸化数から理解しよう!
第二級アルコール
第二級アルコールに酸化剤を入れると、
「ケトン」が生じます。
実はこれは第一級アルコールと全く仕組みです。
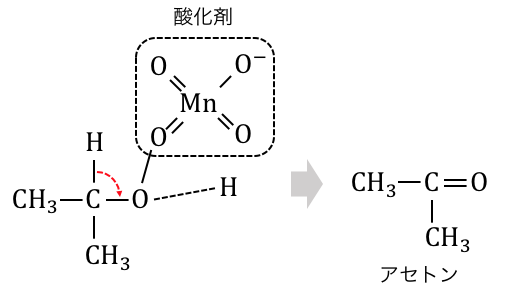
このようにしてケトンが生じます。
第一級では水素だった部分が炭素になっているので、
これ以上反応は進みません。
以上の反応の半反応式は以下のようになります(2-プロパノールの例)。
第三級アルコール
第三級アルコールは酸化されません。
先ほどまでは水素から電子を奪っていましたが、
その水素がいなくなるから当然ですね。
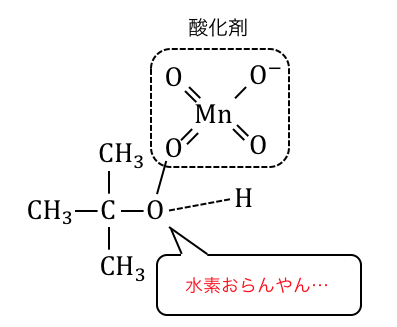
水素の電気陰性度は2.1、炭素の電気陰性度は2.5で、炭素から奪うのは大変だけど水素からなら奪えるのです。
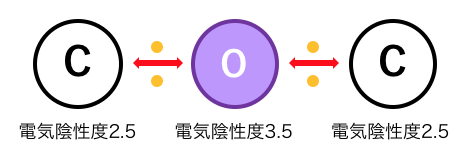
エーテルとは
「エーテル」とは、炭化水素の炭素の間に-O-が割り込んだような化合物です。
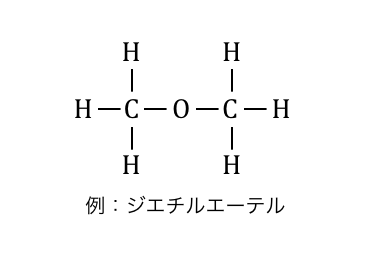
アルコールは炭素と水素の間に-O-が割り込んだもの、
エーテルは炭素と炭素の間に-O-が割り込んだものなので、
分子式はともに同じになります。
ただしアルコールは電気陰性度の偏りがあるのに対し、
エーテルはうまく釣り合っているため、
エーテルの反応性はかなり低いです。
先ほども説明した通り、
アルコールの分子間脱水によって作ることができます。
まとめ
今回は炭化水素に-OHがくっついたアルコールと、
同じ分子式で表されるエーテルの解説でした。
アルコールの主な3つの反応は、
・ナトリウムとの反応→金属と酸の反応
・脱水反応→熱分解反応
・酸化反応→-OHの酸素が原因になる酸化反応
でした。
酸化反応も級数によって様子が違いますが、
仕組みは全く変わらなかったですね。
エーテルは入試的には製法くらいしか問われないので、
この機会に完璧にしておきましょう。














分子内脱水で構造異性体3つは間違っていないでしょうか?
シストランスは構造異性体では無いと思います
コメントありがとうございます。
ほんとですね、雑な言葉の使い方をしてしまいました…。
訂正しておきました、ご指摘ありがとうございますm(__)m